
以淀粉和必要的无机试剂为原料制取 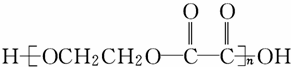
的过程是:淀粉 葡萄糖
葡萄糖 乙醇
乙醇 乙烯
乙烯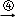 二溴乙烷
二溴乙烷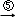 乙二醇
乙二醇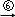 乙二酸
乙二酸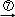
(1)指出反应类型:③ ;④ ;⑤ ;⑥ ; ⑦ .
(2)写出化学方程式:
① : ;② ;③ ;⑤ ;⑦ .
考点:
有机物的合成.
专题:
有机物的化学性质及推断.
分析:
由合成流程可知,①为淀粉水解反应,②为葡萄糖的酒化反应,③为乙醇的消去反应,④为乙烯的加成反应,⑤为卤代烃的水解反应,⑥为乙二醇的氧化反应,⑦为乙二酸、乙二醇的缩聚反应,以此来解答.
解答:
解:由合成流程可知,①为淀粉水解反应,②为葡萄糖的酒化反应,③为乙醇的消去反应,④为乙烯的加成反应,⑤为卤代烃的水解反应,⑥为乙二醇的氧化反应,⑦为乙二酸、乙二醇的缩聚反应,
(1)由上述分析可知③为消去反应,④为加成反应,⑤为水解反应,⑥为氧化反应,⑦为缩聚反应,
故答案为:消去反应;加成反应;水解反应;氧化反应;缩聚反应;
(2)反应①为(C6H10O5)n+nH2O nC6H12O6,反应②为C6H12O6
nC6H12O6,反应②为C6H12O6 2CH3CH2OH+2CO2↑,反应③为C2H5OHCH2
2CH3CH2OH+2CO2↑,反应③为C2H5OHCH2 CH2=CH2↑+H2O,
CH2=CH2↑+H2O,
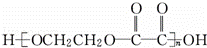
反应⑤为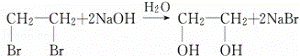 ,反应⑦为
,反应⑦为 ,
,
故答案为:(C6H10O5)n+nH2O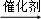 nC6H12O6;为C6H12O6
nC6H12O6;为C6H12O6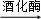 2CH3CH2OH+2CO2↑;C2H5OHCH2
2CH3CH2OH+2CO2↑;C2H5OHCH2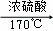 CH2=CH2↑+H2O;
CH2=CH2↑+H2O;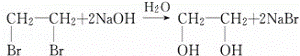 ;
; .
.
点评:
本题考查有机物的合成,为高频考点,把握以淀粉为原料合成高分子化合物流程中发生的反应为解答的关键,注意转化中官能团的变化,题目难度不大.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
分离四氯化碳和甲苯的混合物(两者互溶,沸点分别为76.75℃和110.6℃),可选用的分离方法为( )
|
| A. | 萃取法 | B. | 蒸馏法 | C. | 结晶法 | D. | 分液法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室配制欲配制480mL4.0mol•L﹣1的NaOH溶液.根据配置溶液的具体过程回答下列问题:
(1)配制该溶液应选用的玻璃仪器主要有:天平、量筒、烧杯、玻璃棒、 、 .
(2)用托盘天平称取 g固体NaOH.
(3)将称好的NaOH固体放至500mL的大烧杯中,倒入蒸馏水,用玻璃棒搅拌至完全溶解.待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶.
(4)用少量蒸馏水洗涤烧杯2﹣3次,并将每次洗涤的溶液都注入容量瓶,轻轻晃动容量瓶,使溶液混和均匀.
(5)定容.滴加蒸馏水至液面与刻度线相切.盖好瓶塞,摇匀.
(6)以下因素会造成实验结果偏低的是 (不一定是单选,多选漏选均不得分).
A.定容时观察液面仰视 B.定容时观察液面俯视
C.有少量NaOH溶液残留在烧杯中 D.容量瓶中原来有少量蒸馏水
(7)实验室中加热灼烧固体时,被加热的固体应盛在什么仪器中,写出该仪器的名称 .
(8)某同学用托盘天平称量的某石块的质量,读数如图所示,其读数的准确值是 g.
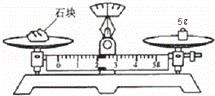
查看答案和解析>>
科目:高中化学 来源: 题型:
下列基态原子与离子的电子排布式错误的是( )
|
| A. | K:1s22s22p63s23p64s1 |
|
| B. | F﹣:1s22s22p6 |
|
| C. | Fe:1s22s22p63s23p63d54s2 |
|
| D. | Kr:1s22s22p63s23p63d104s24p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
基态原子的核外电子排布为[Kr]4d105s1的元素属于的区、周期和族为( )
|
| A. | p区、第五周期、IB族 | B. | ds区、第五周期、Ⅷ族 |
|
| C. | d区、第四周期、IB族 | D. | ds区、第五周期、IB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.Na2O、Mn2O7、Fe2O3均为碱性氧化物
B.烧碱不是碱、石炭酸不是酸、双氧水不是水
C.电解质在水溶液中的反应都是离子反应
D.单质都有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象不能说明相关结论的是( )
A.向Al(OH)3沉淀中滴加NaOH溶液或盐酸,沉淀均消失,说明Al(OH)3是两性氢氧化物
B.将金属钠投入冷水中,钠熔为小球,说明钠与水的反应为放热反应且钠的熔点低
C.向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl溶解度比Ag2S大
D.将铜与浓硫酸共热,产生使石蕊溶液变红的气体,说明浓硫酸被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1 mol N-H键所需的能量(kJ)是
A.391 B.516 C.658 D.194

查看答案和解析>>
科目:高中化学 来源: 题型:
镁化合物具有广泛用途,请回答有关镁的下列问题:
(1)单质镁在空气中燃烧的主要产物是白色的______________,还生成少量的______________(填化学式);
(2)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是_____________,该 化合物水解的化学方程式为_________________;
化合物水解的化学方程式为_________________;
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
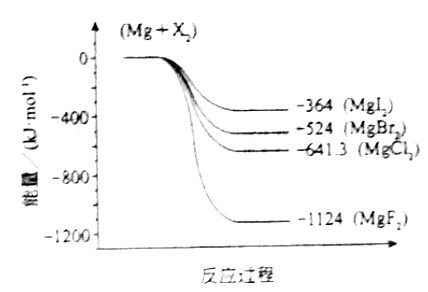
下列选项中正确的是_______________(填序号)。
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
②Mg与F2的反应是放热反应
③MgBr2与Cl2反应的△H<0
④化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
⑤MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com