
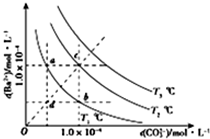
| A. | T2温度下将d点的溶液蒸发浓缩可变为c点 | |
| B. | a点的Ksp小于B点的Ksp | |
| C. | b点溶液中加入BaCl2固体可变为c点 | |
| D. | a点溶液蒸发浓缩恢复到原温度可变为b点 |
分析 A.d点的含义为T2温度下,溶液中的离子积Qc<Ksp(T1),为不饱和溶液,蒸发浓缩可变为饱和溶液;
B.温度相同,则溶度积常数相同;
C.加入BaCl2固体,相当于增加溶液中的Ba2+的浓度,b点时溶液T1温度下的为饱和溶液,增加Ba2+的浓度,反应向生成沉淀的方向进行;
D.a点时温度为T2下的饱和溶液,溶液蒸发浓缩恢复到原温度析出晶体,溶液中不可能CO32-的浓度会增加.
解答 解:A.d点的含义为T2温度下,溶液中的离子积Qc<Ksp(T1),为不饱和溶液,蒸发浓缩可变为饱和溶液,c为T1温度下的饱和溶液,则T2温度下将d点的溶液蒸发浓缩可变为c点,故A正确;
B.a点和b点时的温度均为T2,温度相同,溶度积常数相同,则a点的Ksp等于b点的Ksp,故B错误;
C.加入BaCl2固体,相当于增加溶液中的Ba2+的浓度,b点时溶液为T1温度下的饱和溶液,增加Ba2+的浓度,反应向生成沉淀的方向进行,但不可能变为温度为T2下的饱和溶液c点,故C错误;
D.a点时温度为T2下的饱和溶液,溶液蒸发浓缩恢复到原温度析出晶体,溶液中不可能CO32-的浓度会增加,则不可能变为b点,故D错误.
故选A.
点评 本题考查沉淀溶解平衡知识,结合图象和溶度积常数分析是解题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 原子半径:Z>Y>X | |
| B. | 气态氢化物的稳定性:W>R | |
| C. | WX3和水反应形成的化合物是离子化合物 | |
| D. | Y和Z两者最高氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔沸点高低:CH4<SiH4<GeH4<SnH4 | |
| B. | 离子半径大小:Cl-<Mg2+<O2-<F- | |
| C. | 分散质微粒直径大小:Fe(OH)3胶体>CaCO3悬浊液>NaCl溶液 | |
| D. | 酸性强弱:H2SO4<H3PO4<H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol熔融的NaHSO4中含有的离子数目为1.5NA | |
| B. | 标准状况下,2.24LCl2溶于水,转移电子数为0.1NA | |
| C. | 氢气与氯气反应生成标准状况下22.4L氯化氢,则断裂化学键总数为NA | |
| D. | 电解精练铜时,转移1mol电子时,阳极溶解的铜的质量为32g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜屑加入 Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 将氯化亚铁酸性溶液和H2O2混合:Fe2++2H++H2O2═Fe3++2H2O | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,
, 叫狄尔斯阿德而反应,用 于构建六元环,则下列说法不正确的是( )
叫狄尔斯阿德而反应,用 于构建六元环,则下列说法不正确的是( )| A. | 狄尔斯阿德而反应为加成反应,原子利用率为100% | |
| B. |  可通过狄尔斯阿德而反应合成,而 可通过狄尔斯阿德而反应合成,而 不可通过狄尔斯阿德而反应合成 不可通过狄尔斯阿德而反应合成 | |
| C. | 2-甲基-1,3-丁二烯和丙炔发生上述反应产物有两种 | |
| D. |  可由环戊二烯与丙烯酸甲酯发生上述反应得到 可由环戊二烯与丙烯酸甲酯发生上述反应得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 实验结论 |
| A | 常温下,将大小、形状形态的锌和铝分别加入到等体积98%的浓硫酸中,观察到前者反应速率快 | 锌比铝活泼 |
| B | 向某溶液中加入盐酸酸化的氯化钡溶液,产生白色沉淀 | 该溶液中一定含有SO42- |
| C | 将盐酸滴入碳酸钠溶液中,产生气泡 | 非金属性:Cl大于C |
| D | 向某溶液中加入氢氧化钡溶液丙加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com