
【题目】下列叙述中正确的是 ( )
A. FeCl3溶液、Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是有没有丁达尔效应
B. 根据分散系的稳定性大小将混合物分为胶体、溶液和浊液
C. 将几滴汽油加入装有10mL水的试管中,用力振荡形成胶体
D. 胶体、分散系、混合物概念间的从属关系可用图表示

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-1gc。常温下,某浓度的H2A溶液在不同pH下,测得pC(H2A)、pC(HA-)、pC(A2-)的变化如图所示。下列说法正确( )
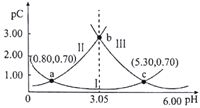
A. 曲线Ⅱ表示pC(HA-)随pH的变化
B. 当pH=1.40时,c(H2A)>c(A2-)>c(HA-)
C. 常温下,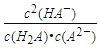 =104.50
=104.50
D. a、b、c三点对应的溶液中,c(H2A)+c(HA-)+c(A2-)的值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。

(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 。
(4)Y 与Z 可形成YZ42-
①YZ42-的空间构型为 。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在室温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2% H2O2溶液 | 无 |
② | 10mL5% H2O2溶液 | 无 |
③ | 10mL5% H2O2溶液 | 1mL0.1mol/LlFeCl3溶液 |
④ | 10mL5% H2O2溶液+少量HCI溶液 | 1mL0.1mol/LlFeCl3溶液 |
⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol/LlFeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________。
(2)实验①和②的目的是_________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进________________________。
(3)写出实验③的化学反应方程式___________________________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析上图能够得出的实验结论是__________________________________________。
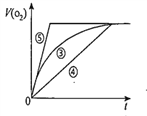
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙二酸晶体熔点101.5℃;乙二酸晶体加热分解的方程式为:H2C2O42H2O![]() 3H2O + CO2↑+ CO↑。现利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。请回答下列问题:
3H2O + CO2↑+ CO↑。现利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。请回答下列问题:

(1)检验装置A气密性的方法是________________________________________________
(2)A装置是否有误_____________(填“是”或“否”),原因为_______________________
(3)按气流方向连接各仪器,用数字表示接口的连接顺序:①→_________________________;
(4)该套装置有明显缺陷,请予以更正________________________________________________
(5)证明CO存在的实验现象是_________________________________________________;
(6)根据题给的数据,假设反应产生的气体全部排出,并与吸收液充分反应(提示:B、C中澄清石灰水均先变浑浊,后又变澄清),最终D中生成了两种物质,则这两种生成物的化学式及对应的物质的量分别是①_______________,②_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1℃时,在四个容积均为1L的恒容密闭容器中发生反应:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ΔH,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n为常数),测得有关实验数据如下:
N2(g)+2H2O(g) ΔH,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n为常数),测得有关实验数据如下:
容器编号 | 物质的起始浓度 (mol/L) | 速率 (mol·L-1·s-1) | 物质的平衡浓度 (mol/L) | |
c(NO) | c(H2) | c(N2) | ||
Ⅰ | 6×10-3 | 1×10-3 | a×10-3 | 2×10-4 |
Ⅱ | 6×10-3 | 2×10-3 | 2a×10-3 | |
Ⅲ | 1×10-3 | 6×10-3 | b×10-3 | |
Ⅳ | 2×10-3 | 6×10-3 | 4b×10-3 | |
下列说法正确的是
A. m=2,n=1
B. 达到平衡时,容器Ⅱ与容器Ⅳ的总压强之比为1:2
C. 温度升高为T2℃,测得平衡时,容器Ⅱ中c(H2O)=3.8×10-4mol/L,则ΔH>0
D. T1℃时,容器Ⅲ中达到平衡后再充入NO、H2O(g)各2×10-4mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确
①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al![]() Al2O3+2Fe;1∶2
Al2O3+2Fe;1∶2
③SiO2+3C![]() SiC(硅为+4价)+2CO↑;1∶2
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O===2HNO3+NO;2∶1
A. ①③ B. ②③ C. ②④ D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com