
| A. | He | B. | CH4 | C. | H2 | D. | CO2 |
科目:高中化学 来源: 题型:实验题
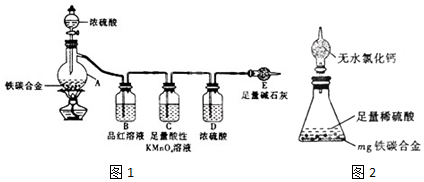
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
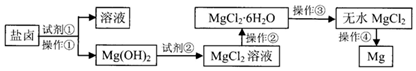
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从反应开始到平衡时,用H2表示的平均反应速率为0.15 mol•L-1•min-1 | |
| B. | 反应达到平衡时,NH3的物质的量浓度是0.5 mol•L-1 | |
| C. | 反应达到平衡时,N2和H2的物质的量之比一定为1:3 | |
| D. | 反应达到平衡时,反应物和生成物的总的物质的量之比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子越稳定,其熔沸点越高 | |
| B. | HF的热稳定性很好,是因为HF分子间存在氢键 | |
| C. | 放热反应都不需要加热就可以进行 | |
| D. | 吸热反应不一定需要加热条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | W的氢化物比Z的氢化物稳定 | |
| B. | 最高价氧化物对应的水化物的酸性W比Z弱 | |
| C. | Z的单质与氢气反应较Y剧烈 | |
| D. | X、Y的单质易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
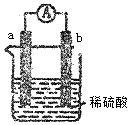
| A. | 电解质溶液中的SO42-向b极移动 | |
| B. | 导线中有电子流动,电子从b极流到a极 | |
| C. | a极上发生了还原反应 | |
| D. | b极上有无色气泡产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com