
【题目】工业上可用粗硅(含铁、铝、硼、磷等杂质)与干燥的HCl气体反应制得SiHCl3:Si+3HCl=SiHCl3+H2,SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅。
有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | SiHCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | — | 315 | 33.0 | — |
熔点/℃ | -70.0 | -107.2 | — | — | -126.5 | — |
升华温度/℃ | — | — | 180 | 300 | 162 |
(1)粗硅与HCl反应完全后,经冷凝得到的SiHCl3中含有少量SiCl4,提纯SiHCl3可采用
___________的方法
(2)实验室也可用SiHCl3与过量干燥的H2反应制取纯硅,装置如下图所示(加热和夹持装置略去):

①装置B中的试剂是___________,装置C需水浴加热,目的是 ____________________。
②反应一段时间后,装置D中可观察到有晶体硅生成,装置D不能采用普通玻璃管的原因是_____________。
【答案】 蒸馏 浓硫酸 使SiHCl3气化,与氢气反应 SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,温度太高,普通玻璃管易熔化
【解析】(1)根据题示的数据可知,可以利用沸点的不同提纯SiHCl3,操作为蒸馏,故答案为:蒸馏;
(2)①生成的氢气中含有水蒸气,进入装置D之前需要干燥,装置B中的试剂可以干燥氢气,浓硫酸是常用的干燥剂,因此装置B中的试剂是浓硫酸,装置C需水浴加热,目的是使SiHCl3汽化,在D中与氢气反应,故答案为:浓硫酸;使SiHCl3气化,与氢气反应;
②SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,温度太高,普通玻璃管易熔化,故答案为:SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,温度太高,普通玻璃管易熔化。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.23gNa与足量H2O反应完全后失去2NA个电子
B.1molCu和足量热浓硫酸反应可生成NA个SO3分子
C.标准状况下,22.4LN2和H2混合气中含2NA个原子
D.3mol单质Fe完全转变为Fe3O4 , 失去9NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.升高温度可降低活化能
B.废电池需回收,主要是要利用电池外壳的金属材料
C.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
D.推广使用太阳能、风能、地热能、氢能,有利于缓解温室效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1mol任何气体的体积都为22.4 L
B. 1 mol任何物质在标准状况下所占的体积都为22.4 L
C. 标准状况下,1 mol水所占的体积是22.4 L
D. 标准状况下,22.4 L的任何气体的物质的量都是1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1为实验室制备、收集少量HCl的装置.
①制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用图2中的 . 
②请解释能用浓硫酸和浓盐酸制备HCl气体的原因 .
③装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯胺可用对硝基甲苯在酸性条件下用铁粉还原制得:

主要反应物和产物的物理性质见下表:
化合物 | 物质状态 | 溶解性 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
对硝基甲苯 | 浅黄色晶体 | 不溶于水,溶于乙醇、苯 | 51.4 | 237.7 | 1.286 |
对甲基苯胺 | 白色片状晶体 | 微溶于水,易溶于乙醇、苯 | 43~45 | 200~202 | 1.046 |
对甲基苯胺盐酸盐 | 白色晶体 | 易溶于水,不溶于乙醇、苯 | 243~245 | —— | —— |
苯 | 无色液体 | 不溶于水,溶于乙醇 | 5.5 | 80.1 | 0.874 |
实验流程如下:

请回答下列问题:
(1)反应装置如图,a处缺少一装置_____________(填仪器名称)
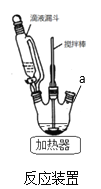
(2)步骤②中加苯的作用是_____________,步骤②中用5%碳酸钠溶液调pH=7~8的原因_________
(3)步骤③得到的固体物质为_________
(4)步骤④中加入盐酸的作用是_____________
(5)步骤⑤中通过加入氢氧化钠溶液使对甲基苯胺结晶析出的原理为_____________
(6
A. 蒸馏水 B.乙醇 C.NaOH溶液 D.HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是 ( )
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.NaClO c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥ pH=4浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
A. ③⑤⑥ B. ①③⑤ C. ①②④ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度T℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下[2NO2(g)![]() N2O4(g) △H<0]:
N2O4(g) △H<0]:
容器 | 物质 | 起始浓度/(mol | 平衡浓度/(mol |
Ⅰ | N2O4 | 0.100 | 0.040 |
NO2 | 0 | 0.120 | |
Ⅱ | N2O4 | 0 | 0.0142 |
NO2 | 0.100 | 0.0716 |
下列说法不正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应的转化率a(N2O4)>a(NO2)
B. 平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ)
C. 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(I)=![]()
D. 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。请回答:
(1)Y的最高价氧化物对应水化物的化学式是_________________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是_________________,此液体具有的性质是______________(填写序号字母)
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼热后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1mol该气体被O2完全氧化放热98.0kJ,若2mol该气体与1molO2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为_____。
②原无色有刺激性气味的气体与含1.5molY的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com