
 室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | pH=7时,两种酸所用NaOH溶液的体积相等 | |
| C. | V(NaOH)=10.00 mL 时$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COO)}$>1 | |
| D. | V(NaOH)=20.00 mL 时,c(Cl-)<c(CH3COO-) |
分析 A.根据盐酸和醋酸在滴定开始时的pH来判断;
B.醋酸钠水解呈碱性,氯化钠不水解;
C.醋酸电离大于醋酸根的水解程度;
D.V(NaOH)=20.00 mL 时,二者反应生成氯化钠和醋酸钠.
解答 解:A.滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图Ⅱ,滴定醋酸的曲线是图Ⅰ,故A错误;
B.醋酸钠水解呈碱性,氯化钠不水解,pH=7时,醋酸所用NaOH溶液的体积小,故B错误;
C.加入10mL氢氧化钠时,溶液中恰好为同浓度的醋酸和醋酸钠,醋酸电离程度大于醋酸根离子的水解程度,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COO)}$>1,故C正确;
D.V(NaOH)=20.00 mL 时,二者反应生成氯化钠和醋酸钠,由于醋酸根离子发生水解,则c(Cl-)<c(CH3COO-),故D错误;
故选C.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确图象曲线各点对应溶质组成为解答关键,注意利用醋酸电离大于醋酸根的水解程度解答,试题有利于提高学生的分析能力及灵活应用能力.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
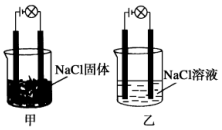 某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是
某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是| A. | NaCl溶液是电解质 | |
| B. | 在通电的条件下,NaCl在水中电离出大量的离子而导电 | |
| C. | NaCl固体中无阴阳离子,因此不能导电 | |
| D. | 同一温度下,将乙中NaCl溶液换成等浓度的MgCl2溶液,溶液导电性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,用1L1mol•L-1Na2SO3溶液吸收SO2时,溶液pH随SO2的物质的量的变化如图所示,下列说法正确的是( )
常温下,用1L1mol•L-1Na2SO3溶液吸收SO2时,溶液pH随SO2的物质的量的变化如图所示,下列说法正确的是( )| A. | Na2SO3溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) | |
| B. | 当吸收液呈中性时,c(Na+)=c(HSO3-)+2c(SO32-) | |
| C. | M 点时溶液中:c(SO32-)>c(HSO3-) | |
| D. | 向N点的吸收液中加水可使溶液的pH由6.2升高到7.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Ca2+、NO3-、CO32- | B. | K+、Na+、Cl-、SO42- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | NH4+、K+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
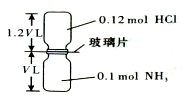 已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )
已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )| A. | 反应后瓶内压强是反应前的$\frac{1}{10}$ | |
| B. | 装置中氢元素的总质量为0.42 g | |
| C. | 生成物的分子数目为0.1 NA | |
| D. | 反应结束后,两个集气瓶很容易分开 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
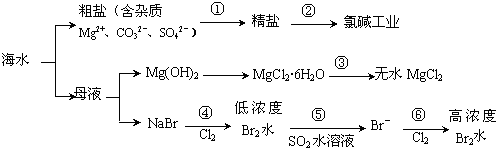
| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 | |
| D. | 在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2.24 L Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 平衡时,各容器的压强:②=①=③ | B. | 平衡时,I2的浓度:②>①=③ | ||
| C. | 平衡时,I2的体积分数:②=①=③ | D. | 从反应开始到达平衡的时间:①>②=③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漏斗、烧杯、蒸发皿、酒精灯 | B. | 量筒、烧杯、试管夹、蒸发皿 | ||
| C. | 玻璃棒、蒸发皿、漏斗、集气瓶 | D. | 铁架台、天平、长颈漏斗、酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 中的※C原子为手性碳原子;若一个碳原子上连着2个C=C(如
中的※C原子为手性碳原子;若一个碳原子上连着2个C=C(如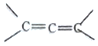 )时,极不稳定,不存在.现有某链烃C7H10的众多同分异构体中:
)时,极不稳定,不存在.现有某链烃C7H10的众多同分异构体中: ═CH-CH3
═CH-CH3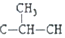 ═CH2
═CH2 -CH≡CH3
-CH≡CH3 ;
; .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com