
分析 ①由乙炔制氯乙烯,发生乙炔与HCl的加成反应;
②乙烷在空气中燃烧,为氧化反应;
③乙烯使溴的四氯化碳溶液褪色,发生乙烯与溴的加成反应;
④乙烯使酸性高锰酸钾溶液褪色,发生氧化反应;
⑤由乙烯制聚乙烯,发生加聚反应;
⑥甲烷与氯气在光照的条件下反应,发生取代反应;
⑦甲苯制三硝基甲苯,苯环上H被取代,为取代反应,以此来解答.
解答 解:①由乙炔制氯乙烯,发生乙炔与HCl的加成反应;
②乙烷在空气中燃烧,为氧化反应;
③乙烯使溴的四氯化碳溶液褪色,发生乙烯与溴的加成反应;
④乙烯使酸性高锰酸钾溶液褪色,发生氧化反应;
⑤由乙烯制聚乙烯,发生加聚反应;
⑥甲烷与氯气在光照的条件下反应,发生取代反应;
⑦甲苯制三硝基甲苯,苯环上H被取代,为取代反应,
则属于取代反应的是⑥⑦;属于氧化反应的是②④;属于加成反应的是①③;属于聚合反应的是⑤,
故答案为:⑥⑦;②④;①③;⑤.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机反应类型的判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 苯与氢气的反应: +3H2$→_{△}^{Ni}$ +3H2$→_{△}^{Ni}$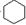 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ 其热化学方程式为:N2(g)+3H2(g)$?_{500℃/30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则1mol稀H2SO4和足量KOH反应的反应热为△H=2×(-57.3)kJ/mol | |
| D. | 同温同压下H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
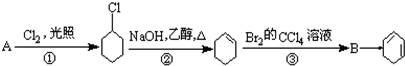
 ,B的名称是1,2-二溴环己烷.
,B的名称是1,2-二溴环己烷.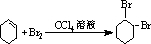 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.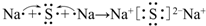 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 需要区分的物质 | 实验方法 | |
| A | 磷酸钙和氯化铵 | 溶于水 | 与熟石灰混合研磨 |
| B | 氢氧化钠固体和熟石灰 | 将两种固体溶于水 | 溶于水,向所得溶液中分别吹入CO2气体 |
| C | 硫酸钾和碳酸钾 | 加硝酸钡溶液 | 加水溶解 |
| D | 硬水和软水 | 肥皂水 | 加热、煮沸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
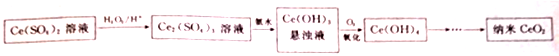
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com