
| A. | 8.0gCuO和Cu2S的混合物含铜原子个数为0.2NA | |
| B. | 标准状况下,11.2L乙醇蒸气含共价键数目为4NA | |
| C. | 1molK与O2完全反应生成K2O、K2O2、KO3的混合物,转移电子数为NA | |
| D. | 1L0.2mol•L-1NH4ClO4溶液中含NH4+数目为0.2NA |
分析 A.CuO和Cu2S中铜元素的质量分数相等,都是80%,混合物中铜元素的质量为6.4g,物质的量为0.1mol,铜原子个数为0.1NA;
B.标准状况下,乙醇是液体;
C.根据K$\stackrel{-e-}{→}$K+计算转移电子数;
D.NH4+发生水解,使得NH4+数目小于0.2NA.
解答 解:A.8.0gCuO和Cu2S的混合物中含有铜元素的质量为:8.0g×$\frac{64}{80}$=6.4g,含有的铜的物质的量为0.1mol,含有铜原子数一定为0.1NA,故A错误;
B.标准状况下,乙醇是液体,故B错误;
C.K$\stackrel{-e-}{→}$K+,1molK完全反应失去电子为NA,所以转移电子数为NA,故C正确;
D.NH4+发生水解,使得NH4+数目小于0.2NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的应用,主要考查质量换算物质的量计算微粒数、气体摩尔体积的条件应用、氧化还原反应的电子转移计算、盐类的水解,题目难度中等.


科目:高中化学 来源: 题型:解答题
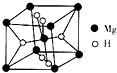 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
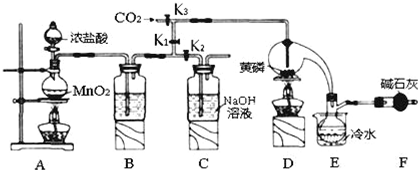
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子中有3个C-C键和3个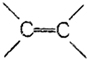 键 键 | |
| B. | 苯分子中的碳碳键是一种介于C-C键和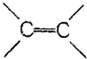 键之间的特殊的键 键之间的特殊的键 | |
| C. | 苯分子中的6个碳碳键不是完全相同的 | |
| D. | 苯分子具有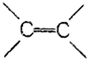 键可以使溴水褪色 键可以使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X>W | |
| B. | Z单质在过量的X单质中燃烧生成ZX3 | |
| C. | 元素Y和W能形成离子化合物 | |
| D. | 元素W、X各自最高和最低化合价的代数和分别为0、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
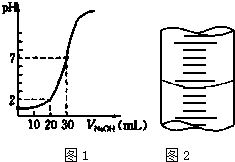 用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:
用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com