
【题目】Cl2是中学化学重要气体之一,实验室常用二氧化锰与浓盐酸反应制取Cl2。请回答下列问题:
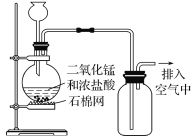
Ⅰ实验室用二氧化锰制取Cl2的化学方程式为______________________________,如图所示制取氯气装置中至少存在_____________明显错误。
Ⅱ实验室也可用高锰酸钾与浓盐酸反应制取Cl2,并收集和检验Cl2的性质。
已知:①KMnO4在不加热的条件下可与浓盐酸发生反应制取Cl2。
②无水CaCl2可吸收水蒸气。
(1)将反应原理补充完整:2KMnO4+16HCl(浓)=________+5Cl2↑+8H2O。
(2)选择实验装置,完成相应的实验:
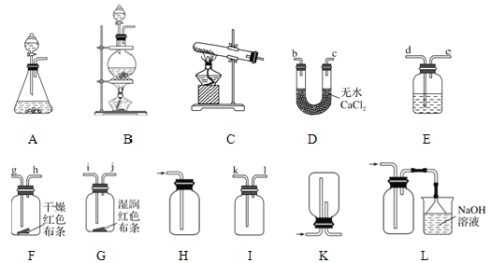
①若制取、收集干燥纯净的Cl2,按装置连接顺序可以选择其中的______(填序号)进行实验。
②若按A-E-D-F-G-L顺序连接装置进行实验,可得出的实验结论是___________。
③在上述实验①和②中,制取氯气前必须进行的一项操作是______,装置E中的试剂是______。
【答案】4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O 3 2KCl+2MnCl2 A-E-D-I-L或A-E-D-L Cl2无漂白性,HClO有漂白性或干燥的氯气无漂白性,潮湿的氯气有漂白性 检查装置的气密性 饱和食盐水
MnCl2+Cl2↑+2H2O 3 2KCl+2MnCl2 A-E-D-I-L或A-E-D-L Cl2无漂白性,HClO有漂白性或干燥的氯气无漂白性,潮湿的氯气有漂白性 检查装置的气密性 饱和食盐水
【解析】
(1)根据反应物写出化学方程式;制取氯气的要求和装置分析错误;根据原子守恒补充完整;
①若制取、收集干燥纯净的Cl2,需要发生装置,除杂质装置,干燥装置,收集装置;
②若按A-E-D-F-G-L顺序连接装置进行实验,检验氯气是否具有漂白性;
③在上述实验①和②中,制取氯气前必须进行的一项操作是检查装置的气密性。
Ⅰ实验室用二氧化锰制取Cl2的化学方程式为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O,制取氯气时浓盐酸需要用分液漏斗盛放,而图中用的是长颈漏斗,错误;该反应需要加热,缺少酒精灯,氯气有毒,不能直接排放到空气中,需要尾气处理,共有3处错误,故答案为:4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O,制取氯气时浓盐酸需要用分液漏斗盛放,而图中用的是长颈漏斗,错误;该反应需要加热,缺少酒精灯,氯气有毒,不能直接排放到空气中,需要尾气处理,共有3处错误,故答案为:4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O;3
MnCl2+Cl2↑+2H2O;3
Ⅱ(1)KMnO4在不加热的条件下可与浓盐酸发生反应制取Cl2,生成氯化钾,氯化锰,氯气和水,再根据原子守恒配平,故补充完整是2KCl+2MnCl2,故答案为:2KCl+2MnCl2;
(2)①若制取、收集干燥纯净的Cl2,需要发生装置A,除杂装置需要用饱和食盐水除去氯气中的氯化氢,即是装置E,用氯化钙(浓硫酸)吸收氯气中的水,即是装置D(E),因为氯气的密度大于空气的密度,用向上排空气法收集气体,即是装置I,氯气有毒,不能直接排放到空气中,需要尾气处理,用氢氧化钠溶液吸收,需要装置L,故连接的顺序是A-E-D-I-L或A-E-D-L,故答案为:A-E-D-I-L或A-E-D-L;
②若按A-E-D-F-G-L顺序连接装置进行实验,即是生成的氯气通过饱和的氯化钠溶液除去氯化氢杂质,通过氯化钙除去水,得到干燥的氯气,遇到干燥的有色布条,干燥的有色布条不褪色,说明氯气不具有漂白性,再通入湿润的有色布条,有色布条褪色,说明氯气与水反应生成的次氯酸具有漂白性,所以得出的结论是Cl2无漂白性,HClO有漂白性或干燥的氯气无漂白性,潮湿的氯气有漂白性,故答案为:Cl2无漂白性,HClO有漂白性或干燥的氯气无漂白性,潮湿的氯气有漂白性;
③在上述实验①和②中,制取氯气前必须进行的一项操作是检查装置的气密性,装置E的作用是除去氯气中的氯化氢气体,用的试剂是饱和的氯化钠溶液,故答案为:检查装置的气密性;饱和的氯化钠溶液。


科目:高中化学 来源: 题型:
【题目】镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:

(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用________,要使MgSO4完全转化为沉淀,加入试剂的量应为________________。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_____________。
(3)试剂②选用________;写出其反应的离子方程式_______。
(4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.FeS2![]() SO2
SO2![]() H2SO4
H2SO4
B.N2![]() NH3
NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.Fe![]() FeCl2
FeCl2![]() FeCl3
FeCl3![]() Fe(OH)3
Fe(OH)3
D.MnO2![]() Cl2
Cl2![]() 漂白粉
漂白粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究反应 2X(g)![]() Y(g)+Z(g)的速率影响因素,在不同条件下进行 4 组实验,Y、Z 起始浓度为 0,反应物X 的浓度随反应时间的变化情况如图所示。下列说法不正确的是
Y(g)+Z(g)的速率影响因素,在不同条件下进行 4 组实验,Y、Z 起始浓度为 0,反应物X 的浓度随反应时间的变化情况如图所示。下列说法不正确的是
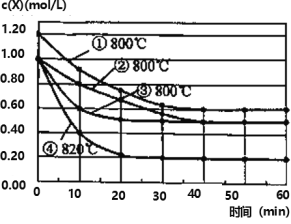
A. 比较实验②、④得出:升高温度,化学反应速率加快
B. 比较实验①、②得出:增大反应物浓度,化学反应速率加快
C. 若实验②、③只有一个条件不同,则实验③使用了催化剂
D. 在 0~10min 之间,实验③的平均速率 v(Y)=0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X、Y、Z是三种常见元素,X原子核内只有一个质子,Y原子的最外层电子数是次外层的三倍,且X、Y、Z均能形成中学常见的双原子气体单质,并有如下转化关系:
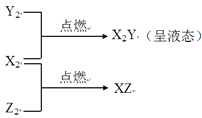
请回答下列问题:
(1)写出Y2的化学式____________。
(2)X2分别在Y2、Z2中点燃时火焰的颜色是________、_________。
(3)Z2与X2Y反应生成两种酸,其化学方程式为 ___________________。
(4)Z2与NaOH溶液反应的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某NH4NO3和(NH4)2SO4混合物的组成,称取4份样品分别加入50.0mL相同浓度的NaOH溶液中,加热充分反应(加热后氨气全部逸出)。加入的混合物的质量和产生的气体体积(标准状况)的关系如下表:
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
NaOH溶液体积(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
样品质量(g) | 3.44 | m | 17.2 | 21.5 |
NH3体积(L) | 1.12 | 2.24 | 5.60 | 5.60 |
试计算:
(1)m=________g;c(NaOH)=___________ mol·L-1
(2)样品中NH4NO3和(NH4)2SO4物质的量之比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Cu2S投入到足量浓硝酸中,收集到气体nmol,向反应后的溶液(存在Cu2+和SO42-)中加入足量NaOH,产生蓝色沉淀,过滤、洗涤、灼烧,得到CuO48.0g,若上述气体为NO和NO2混合物,且体积比为1:2。则n为( )
A.3.28B.1.80C.0.80D.1.63
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则:

(1)O-X段反应的离子方程式为:________________________,
(2)X-Y段反应的离子方程式为_________________________
(3)生成Mg(OH)2的质量为___________________g;
(4)X=________________;Y=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下有①6.72L CH4,②3.01×1023个HCl分子,③13.6g硫化氢,④0.2mol氨气(NH3)。下列对这四种气体的关系从大到小描述不正确的是( )
A.体积②>③>①>④B.密度②>③>④>①
C.质量②>③>①>④D.氢原子数①>④>③>②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com