
| A. | 5.6 g铁与足量稀硝酸反应,转移电子的数目为0.2 NA | |
| B. | 标准状况下,22.4 L二氯甲烷的分子数约为NA | |
| C. | 8.8g乙酸乙酯中含共用电子对数为1.4 NA | |
| D. | 1 L 0.1 mol•L-1氯化铜溶液中铜离子数为0.1 NA |
分析 A.铁与足量稀硝酸反应生成三价铁离子;
B.气体摩尔体积使用对象为气体;
C.乙酸乙酯分子中含有14对共用电子对,根据n=$\frac{m}{M}$计算乙酸乙酯的物质的量,再根据N=nNA计算共用电子对数;
D.铜离子为弱碱阳离子,水溶液中部分水解.
解答 解:A.5.6 g铁物质的量为0.1mol,与足量稀硝酸反应,转移电子的数目为0.3 NA,故A错误;
B.标况下,二氯甲烷为液体,不能使用气体摩尔体积,故B错误;
C.乙酸乙酯分子中含有14对共用电子对,8.8g乙酸乙酯的物质的量为$\frac{8.8g}{88g/mol}$=0.1mol,8.8g乙酸乙酯中共用电子对数为0.1mol×14×NAmol-1=1.4NA,故C正确;
D.铜离子为弱碱阳离子,水溶液中部分水解,所以1 L 0.1 mol•L-1氯化铜溶液中铜离子数小于0.1 NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,注意气体摩尔体积使用条件和对象,注意盐类水解规律,题目难度中等.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题

| A. | 用图1所示装置从KI和I2的固体混合物中回收I2 | |
| B. | 用图2所示装置配制100mL0.10mol•L-1 K2Cr2O7溶液 | |
| C. | 用图3所示装置干燥少量的SO2的气体 | |
| D. | 用图4所示装置蒸干FeCl3饱和溶液制备FeCl3晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向转动 | B. | 平衡不移动 | ||
| C. | C的百分含量增大 | D. | C的百分含量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
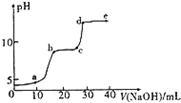 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.| 较大量存在的含金属元素的离子 | 检验方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 使用填埋法处理未经分类的生活垃圾 | 食用油脂能促进人体对某些维生素的吸收 | 利用二氧化碳可制造全降解塑料,有利于缓解温室效应 | 药皂中的少量苯酚,可起到杀菌消毒的作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3+H3O+═NH${\;}_{4}^{+}$+H2O:NH3结合H+的能力比H2O强 | |
| B. | Al2O3+2NaOH═2NaAlO2+H2O:Al2O3是两性氧化物 | |
| C. | HClO+SO2+H2O═HCl+H2SO4:酸性 HClO>H2SO4 | |
| D. | 已知C(s,石墨)=C(s,金刚石)△H=+1.9 kJ/mol:金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
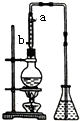 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\underset{\stackrel{{H}^{+}}{→}}{\;}$n(C2H4O).
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\underset{\stackrel{{H}^{+}}{→}}{\;}$n(C2H4O).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氢氟酸来刻蚀玻璃:SiO2+4H++4F-═SiF4↑+2H2O | |
| B. | 用石墨电极电解AlCl3溶液:2Al3++6H2O═2Al(OH)3↓+3H2↑ | |
| C. | 铅蓄电池放电时的反应:Pb+PbSO4+4H++SO42-═2Pb2++SO42-+2H2O | |
| D. | 酸性高锰酸钾溶液与草酸反应:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com