
| A. | 胶体区别于其它分散系的本质特征是具有丁达尔现象 | |
| B. | 煤的气化、石油分馏、海水制镁、海带提碘等过程中都包含化学变化 | |
| C. | 发酵粉能使焙制出的糕点疏松多孔,是因为发酵粉中含有碳酸氢钠 | |
| D. | 加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水 |
分析 A、胶体和其它分散系的本质区别是分散质粒子直径的大小;
B、石油的分馏是利用各组分的沸点的不同,利用加热的方法将各组分分离的方法;
C、碳酸氢钠可以用作发酵粉;
D、KI溶于水.
解答 解:A、胶体和其它分散系的本质区别是分散质粒子直径的大小,而不是丁达尔效应,故A错误;
B、石油的分馏是利用各组分的沸点的不同,利用加热的方法将各组分分离的方法,故石油的分馏是物理变化,故B错误;
C、碳酸氢钠受热易分解生成二氧化碳气体,使烘焙出的糕点疏松多空,故可以用作发酵粉,故C正确;
D、KI溶于水,加碘盐中不用KI的原因是KI有较强的还原性,易被氧化,故D错误.
故选C.
点评 本题考查了化学知识在生活中的应用,难度不大,注意生活常识的积累和基础的巩固.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  分子中至少有9个碳原子处于同一平面上 分子中至少有9个碳原子处于同一平面上 | |
| B. |  的核磁共振氢谱有5个峰 的核磁共振氢谱有5个峰 | |
| C. | 某烯烃与氢气加成后得到2,2-二甲基丁烷,该烯烃的名称是3,3-二甲基-1-丁烯 | |
| D. | 能够测定分子化学键的方法是核磁共振谱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+不能与SCN-形成血红色化合物 | B. | 该晶体中一定含有SCN- | ||
| C. | Fe3+的氧化性比氯气的氧化性强 | D. | Fe2+被氯气氧化成Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| B. | 在一定条件下,苯与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 新型生物柴油和矿物油主要化学成分不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
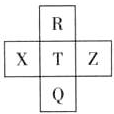 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 单质的沸点:T>Q | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 最高价氧化物的水化物的酸性:T<Q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.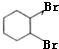 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O,反应类型消去反应;
+2NaBr+2H2O,反应类型消去反应;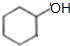 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,反应类型消去反应;
+H2O,反应类型消去反应; +HBr$\stackrel{一定条件}{→}$
+HBr$\stackrel{一定条件}{→}$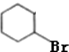 +H2O,反应类型取代反应;
+H2O,反应类型取代反应; +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com