
【题目】下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是
A. K B. Al C. Fe D. Na
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
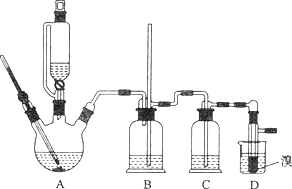
有关数据列表如下:
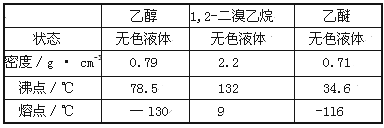
回答下列问题:
(1)写出该实验过程中发生的所有主要反应的化学方程式:________、_________。
(2)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是________(填正确选项前的字母,下同)。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入_______,其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应已经结束的最简单方法是______________(填实验现象)。
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层。
(6)若产物中有少量副产物乙醚,可用_______________的方法除去。
(7)反应过程中应用冷水冷却装置D,其主要目的是____________;但又不能过度冷却(如用冰水),其原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )。
A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体
B.浓硫酸与单质硫反应的化学方程式为:S+2H2SO4(浓) ![]() 3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性
3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性
C.把足量铜粉投入到只含H2SO4 2 mol的浓硫酸中,得到气体体积标准状况下为22.4 L
D.常温下能够用铁、铝等容器盛放浓H2SO4,是因为浓H2SO4的强氧化性使其钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今将Fe16.8g加入到1L浓度为nmol/L的稀硝酸溶液中(假定硝酸还原产物只NO)充分反应后,Fe和HNO3均无剩余,n不可能为
A. 0.6B. 0.8C. 1.0D. 1.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液 ⑦硝酸亚铁溶液。
(1)上述物质中属于电解质的物质序号为______ 。
(2)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是______。
(3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______。
(4)能导电的物质序号为_______________。
(5)④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)___________________________。
(6)实验室用⑤制备胶体的化学方程式为__________________________________。如果将1molFeCl3全部制成胶体,制得的胶体________(选填“带负电”“电中性”“带正电”),胶粒数目________NA(选填“大于”“等于”“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用如下的方法从海水中提碘:
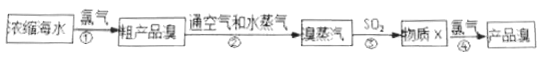
完成下列填空:
(1)上述流程中有两步都涉及到氯气。写出氯元素在周期表中的位置:_________;
氯气分子中所含的化学键名称是:_________;在![]() 原子钟,其核外存在_________种运动状态不同的电子。
原子钟,其核外存在_________种运动状态不同的电子。
(2)和氯元素位于同主族的另外一个短周期元素单质的电子式是:_________,
两者气态氢化物的稳定性是:_________>_________(填写化学式)。
(3)步骤②中体现了溴具有的性质是_______________(文字简述)。
(4)写出步骤③中反应的化学方程式(说明:此反应在水溶液中进行):________________;在该反应中被氧化的元素是:_________。
(5)工业上利用海水还有一个重要的反应就是电解饱和食盐水,此反应中的阴极产物是:_________和_________(写化学式)。
(6)溴蒸汽还可以用饱和碳酸钠溶液来吸收,产物为溴化钠、溴酸钠,同时放出二氧化碳,请写出该反应的化学方程式并标明电子转移方向与数目:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知四种短周期元素A、B、C、D的原子序数依次增大,其中A元素的原子只有一个电子层,又知A与C、B与D分别是同一主族的元素,B、D两元素原子的质子数之和是A、C两元素原子的质子数之和的二倍。请回答下列问题。
(1)由A、B两种元素可形成E、F两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式:_________________________,反应物的电子式是_________,其所含化学键为(选代码)___________。
a.离子键 b.极性共价键 c.非极性共价键
(2)以上四种元素中的部分元素之间形成的化合物,能使品红溶液褪色的物质有_______________(填化学式)。
(3)由A、B、C、D四种元素组成的化合物甲和乙,它们水溶液相互反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx、挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g) △H=_____;
CO2(g)+2H2O(g)+N2(g) △H=_____;
(2)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨。
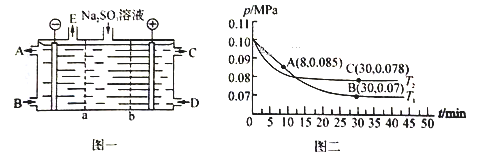
① b表示_____离子交换膜(填“阴”或“阳”)。A—E分别代表生产中的原料或产品。其中C为硫酸,则A表示______________。
②阳极的电极反应式为______________________________________。
(3)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g)![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2〔其中n(SO2):n(O2)=1:1〕,测得容器内总压强与反应时间如图二所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2〔其中n(SO2):n(O2)=1:1〕,测得容器内总压强与反应时间如图二所示。
①图中A点时,SO2的转化率为________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率v0(正)与A点的逆反应速率vA(逆)的大小关系为vA(逆)_____ v0(正) (填“>” “<”或“ = ”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中不正确的是( )
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应将温度计水银球放在被加热的混合液中
C.过滤时,需要用玻璃棒引流
D.配制一定物质的量浓度的溶液时,用蒸馏水洗涤烧杯内壁及玻璃棒2~3次,并将洗涤液都注入容量瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com