
 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.分析 【讨论】该化合物中O元素化合价为-2价、Cl元素化合价为-1价,根据化合物中各元素化合价的代数和为0确定S元素化合价;
Ⅰ.探究反应产物:
(1)SO2Cl2和H2O反应产生白雾,经检验:该无色溶液中的阴离子(除OH-外)只有SO42-、Cl-,说明生成HCl和硫酸,根据反应物和生成物书写方程式;
(2)用硝酸酸化的硝酸银溶液检验氯离子;
Ⅱ.探究反应进行的程度.
亚硫酸的酸性小于盐酸,亚硫酸盐和盐酸酸化的氯化钡不反应,硫酸根离子和盐酸酸化的氯化钡反应生成硫酸钡白色沉淀;
【质疑】SOCl2遇水产生白雾,说明生成HCl,Cl元素化合价不变,则S元素化合价不变,所以同时生成二氧化硫;根据反应物和生成物书写方程式.
解答 解:【讨论】该化合物中O元素化合价为-2价、Cl元素化合价为-1价,根据化合物中各元素化合价的代数和为0知,S元素化合价=0-(-2)×2-(-1)×2=+6,
故答案为:+6;
Ⅰ.探究反应产物:
(1)SO2Cl2和H2O反应产生白雾,经检验:该无色溶液中的阴离子(除OH-外)只有SO42-、Cl-,说明生成HCl和硫酸,根据反应物和生成物书写方程式为SO2Cl2+2H2O=H2SO4+2HCl,故答案为:SO2Cl2+2H2O=H2SO4+2HCl;
(2)用硝酸酸化的硝酸银溶液检验氯离子,其检验方法是:取少量无色溶液放入试管中,加入Ba(NO3)2溶液至不再生沉淀为止,静置.取出上层清液,加入AgNO3溶液,有白色沉淀生成,可知无色溶液中含有Cl-,
故答案为:取少量无色溶液放入试管中,加入Ba(NO3)2溶液至不再生沉淀为止,静置.取出上层清液,加入AgNO3溶液,有白色沉淀生成,可知无色溶液中含有Cl-;
Ⅱ.探究反应进行的程度.
亚硫酸的酸性小于盐酸,亚硫酸盐和盐酸酸化的氯化钡不反应,硫酸根离子和盐酸酸化的氯化钡反应生成硫酸钡白色沉淀,用NaOH吸收的气体溶液中加入盐酸酸化的氯化钡溶液产生白色沉淀,说明剩余气体时SO2被Cl2氧化,即剩余气体中必然存在含有SO2和Cl2,因此SO2与Cl2生成SO2Cl2的反应是可逆反应,
故答案为:由实验中产生的白色沉淀是BaSO4而不是BaSO3,说明用NaOH溶液吸收剩余气体时SO2被Cl2氧化,即剩余气体中必然存在含有SO2和Cl2,因此SO2与Cl2生成SO2Cl2的反应是可逆反应;
【质疑】SOCl2遇水产生白雾,说明生成HCl,Cl元素化合价不变,则S元素化合价不变,所以同时生成二氧化硫,反应方程式为SOCl2+H2O=SO2+2HCl;
SO2 与SOCl2中硫元素均为+4价,SO2与Cl2反应如果生成SOCl2,Cl元素化合价降低、S元素化合价不变,不符合氧化还原反应特点,所以不会生成SOCl2,
故答案为:SOCl2+H2O=SO2+2HCl;SO2 与SOCl2中硫元素均为+4价,SO2与Cl2反应不会生成SOCl2.
点评 本题考查性质实验方案评价,为高频考点,涉及化合价的判断、离子检验、氧化还原反应等知识点,侧重考查学生知识运用能力、获取信息利用信息解答问题能力,熟悉基本理论、元素化合物性质是解本题关键,难点是证明SO2与Cl2是可逆反应的理由.


科目:高中化学 来源: 题型:填空题
| 化学电源名称 | 正极反应式 | 负极反应式 | 电解质溶液pH的变化 |
| 碱性氢氧燃料电池 | O2+2H2O+4e-=4OH- | 此空不用填写 | 变小 |
| 碱性甲烷燃料电池 | 此空不用填写 | CH4+8e-+10OH-=CO32-+7H2O | 变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| B. | 用M表示此反应速率是0.1 amol•(L•min)-1 | |
| C. | 用X表示此反应的反应速率是(0.1-0.2 a)mol•(L•min)-1 | |
| D. | 当混合气体的压强不再发生变化时,说明反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.
某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
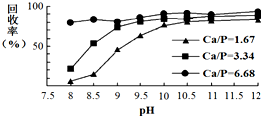 三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来,三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).
三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来,三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到). AgSCN(S)+Cl-(aq);该反应使测定结果偏低;(填偏高,偏低或不变)
AgSCN(S)+Cl-(aq);该反应使测定结果偏低;(填偏高,偏低或不变)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度可以加快反应速率 | |
| B. | 达到化学反应限度时,生成2mol NH3 | |
| C. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 | |
| D. | 向容器中再加入N2可加快正反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锌是一种较活泼的金属,具有广泛的用途.
锌是一种较活泼的金属,具有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com