
| A. | Na2CO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | 0.1 mol•L-1NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| C. | K2S溶液中:2c(K+)═c(H2S)+c(S2-)+c(HS-) | |
| D. | 相同浓度的CH3COOH和NaOH溶液等体积混合后,则:c(CH3COO-)+c(CH3COOH)═c(Na+) |
分析 A.根据碳酸钠溶液中的电荷守恒判断;
B.铵根离子的水解程度较小,则c(NH4+)>c(H+);
C.根据硫化钾溶液中的物料守恒判断;
D.相同浓度的CH3COOH和NaOH溶液等体积混合后,反应后溶质为醋酸钠,根据醋酸钠溶液中的物料守恒分析.
解答 解:A.根据Na2CO3溶液中的电荷守恒可知:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故A错误;
B.氯化铵溶液中,铵根离子部分水解,溶液显示酸性,则c(H+)>c(OH-)、c(Cl-)>c(NH4+),由于铵根离子的水解程度较小,则c(NH4+)>c(H+),溶液中正确的 离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B错误;
C.K2S溶液中满足物料守恒:c(K+)═2c(H2S)+2c(S2-)+2c(HS-),故C错误;
D.相同浓度的CH3COOH和NaOH溶液等体积混合后,恰好反应生成醋酸钠,根据醋酸钠溶液中的物料守恒可得:c(CH3COO-)+c(CH3COOH)═c(Na+),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理的含义为解答关键,B为易错点,注意铵根离子的水解程度较小,试题培养了学生的分析能力及灵活应用能力.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
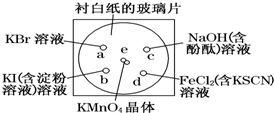 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C2H6O的有机化合物性质相同 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能 途径a:C$→_{高温}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O 途径b:C$→_{燃烧}^{O_{2}}$CO2 | |
| C. | 食物中可加入适量的食品添加剂,如香肠中可以加少量的亚硝酸钠以保持肉质新鲜 | |
| D. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO | B. | Fe2O3 | C. | FeCl3 | D. | Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| N(SO2) | N(NO2) | N(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com