
【题目】下列化合物中含有手性碳原子的是( )
A.CCl2F2B.CH3—CHCl—COOHC.CH3CH2OHD.CH3—OH
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】2-苯基丙烯酸(俗名阿托酸)是一种重要的医药中间体、材料中间体,可用下列方法合成。首先,由A制得E,过程如下:
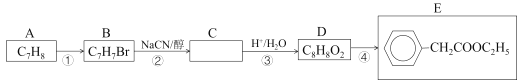
已知:i.CH3CH2Br+NaCN![]() CH3CH2CN+NaBr
CH3CH2CN+NaBr
ii.CH3CH2CN![]() CH3CH2COOH
CH3CH2COOH
(1)烃A的名称是___。D的同分异构体中,能发生银镜反应的芳香族化合物有多种,任写一种该类同分异构体的结构简式___。写出反应④的化学方程式___。
又已知,iii:R—CH2—COOCH2R’+HCOOCH2R”![]() +R”—CH2OH
+R”—CH2OH
然后,通过下列路线可得最终产品:
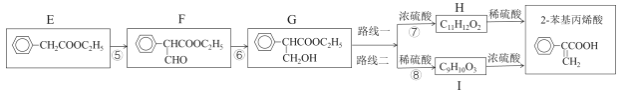
(2)检验F是否完全转化为G的试剂是___。反应⑤的化学方程式是___。
(3)路线二与路线一相比不太理想,理由是___。
(4)设计并完善以下合成流程图___。

(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,wg某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加wg。在①H2;②CO;③CO和H2的混合物 ④HCHO;⑤CH3COOH;⑥HO-CH2-CH2-OH中,符合题意的是
A. 均不符合 B. 只有①②③ C. 只有④⑤ D. 全部符合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
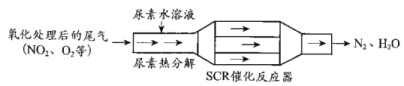
①尿素水溶液热分解为NH3和CO2,该反应的化学方程式:___。
②反应器中NH3还原NO2的化学方程式:___。
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:__。
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g·mol-1)含量的方法如下:取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1mLc1mol·L-1H2SO4溶液吸收完全,剩余H2SO4用v2mLc2mol·L-1NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是__。
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。
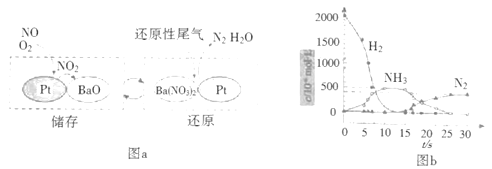
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是__。
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__。
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:___![]() □15NNO+□H2O___。
□15NNO+□H2O___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有七种元素,其中A、X、Y、D、E为短周期主族元素,Z、G为第四周期元素,它们的原子序数依次增大。请回答问题。
A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
X | 元素原子的核外 |
Y | 原子的第一至第四电离能分别是: |
D | 原子核外所有 |
E | 元素的主族序数与周期数的差为4 |
Z | 是前四周期中电负性最小的元素 |
G | 在周期表的第七列 |
(1)已知![]() 为离子化合物,写出其电子式_______________。
为离子化合物,写出其电子式_______________。
(2)X基态原子中能量最高的电子,其电子云在空间有______个方向,原子轨道呈_____形;![]() 的空间构型为__________。
的空间构型为__________。
(3)某同学根据上述信息,推断Y基态原子的核外电子排布为:
![]()
该同学所画的电子排布图违背了________________________。
(4)G位于元素周期表的_________区,原子结构示意图为____________________。
(5)![]() 中心原子的杂化方式为_________,其空间构型为____________________。
中心原子的杂化方式为_________,其空间构型为____________________。
(6)Z元素的基态原子价电子排布式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室需要0.2mol/LNaOH溶液500mL和0.5mol/L硫酸溶液450mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是_______(填序号),配制上述溶液还需用到的玻璃仪器是________________________________(填仪器名称)。

(2)现用质量分数为98%、密度为1.84gcm-3的浓硫酸来配制450mL、0.5molL-1的稀硫酸。计算所需浓硫酸的体积为______mL(保留1位小数),现有①10mL ②25mL③50mL ④100mL四种规格的量筒,你选用的量筒是_____(填代号).
(3)配制时,一般可分为以下几个步骤:
①量取②计算③稀释④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序
为:②→①→③→___→___→___→___→④(填序号)
(4)在配制过程中,其他操作都准确,下列操作中错误的是_______,能引起误差偏高的有___________(填代号)。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量相等的铁片和铜片用导线相连浸入500 mL硫酸铜溶液中构成如图1的装置:
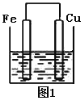
(以下均假设反应过程中溶液体积不变)。
(1)铁片上的电极反应式为______________,
(2)铜片周围溶液会出现___________的现象。
(3)若2 min后测得铁片和铜片之间的质量差为1.2 g,计算:导线中流过的电子的物质的量为__________mol;
(4)金属的电化学腐蚀的本质是形成了原电池。如下图所示,烧杯中都盛有稀硫酸。
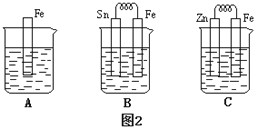
①图2 B中的Sn为________极,Sn极附近溶液的pH(填“增大”“减小”或“不变”)____。
②图2 C中被腐蚀的金属是___________。比较A、B、C中纯铁被腐蚀的速率由快到慢的顺序是______。
(5)人们应用原电池原理制作了多种电池,以满足不同的需要。燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
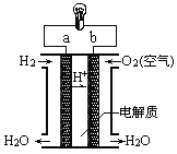
①氢氧燃料电池的正极电极反应是:___________________。电池工作一段时间后硫酸溶液的浓度_____________(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com