
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
①将1L pH=3的A溶液分别与0.001mol/L x L B溶液、0.001mol/L y L D溶液充分反应至中性,x、y的大小关系式y<x;
②浓度均为0.1mol/L A和E溶液,pH:A<E
③浓度均为0.1mol/L C和D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)C是 溶液,D是 溶液.
(2)用水稀释0.1mol/L B溶液时,溶液中随水量的增加而减小的是 .
A.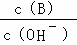 B.
B.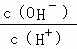 C.c (H+)•c (OH﹣) D.n (OH﹣)
C.c (H+)•c (OH﹣) D.n (OH﹣)
(3)等pH、等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同.则 (填化学式)溶液中锌粉有剩余.
(4)常温下,向0.01mol/L C溶液中滴加0.01mol/L D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为 .
(5)已知常温下Mg(OH)2在pH=12的D溶液中Mg2+的浓度为1.8×10﹣7mol/L,则 Ksp[Mg(OH)2]= .
考点:
酸碱混合时的定性判断及有关ph的计算;盐类水解的应用;难溶电解质的溶解平衡及沉淀转化的本质.
专题:
电离平衡与溶液的pH专题;盐类的水解专题.
分析:
根据中和酸性物质A只有NaOH、NH3•H2O,物质的量的A与等物质的量浓度B和D混合呈中性,D的用量少,说明D碱性比B的碱性强,所以D是NaOH,B为NH3•H2O;根据浓度均为0.1mol•L﹣1C与D溶液等体积混合,溶液呈酸性,则C为NH4HSO4;根据浓度均为0.1mol•L﹣1A和E溶液,pH:A<E,则A为HCl,E为CH3COOH;然后根据问题回答.
解答:
解:(1)中和酸性物质A只有NaOH、NH3•H2O,物质的量的A与等物质的量浓度B和D混合呈中性,D的用量少,说明D碱性比B的碱性强,所以D是NaOH,根据浓度均为0.1mol•L﹣1C与D溶液等体积混合,溶液呈酸性,则C为NH4HSO4;故答案为:NH4HSO4 NaOH;
(2)A、B溶液为氨水溶液,由NH3•H2O⇌OH﹣+NH4+可知,加水促进电离,则n(NH3•H2O)减少,n(OH﹣)增大,则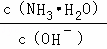 =
=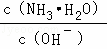 减小,故A正确;
减小,故A正确;
B、由NH3•H2O⇌OH﹣+NH4+可知,加水促进电离,则n(NH3•H2O)减少,n(OH﹣)增大,c(NH3•H2O)、c(OH﹣)都减小,c(H+)减小,则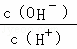 减小,故B正确;
减小,故B正确;
C、因加水稀释时,温度不变,则c(H+)和c(OH﹣)的乘积不变,故C错误;
D、由NH3•H2O⇌OH﹣+NH4+可知,加水促进电离,OH﹣的物质的量增大,故D错误;
故答案为:AB;
(3)等pH、等体积的两份溶液A(HCl)和E(CH3COOH),醋酸是弱电解质存在电离平衡,所以醋酸溶液浓度大于盐酸难度,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,只有强酸中剩余锌,故答案为:HCl;
(4)常温下,向0.01mol/L C(NH4HSO4)溶液中滴加0.01mol/L D(NaOH)溶液至中性,NH4HSO4中滴入NaOH溶液,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH﹣的能力比NH4+结合OH﹣的能量强(原因是产物H2O比NH3•H2O更难电离).当加入等摩尔的NaOH时,正好将H+中和,此时c(Na+)=c(SO42﹣),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(OH﹣)=c(H+),c(Na+)>c(SO42﹣ )>c(NH4+);
故答案为:c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+).
(5)常温下Mg(OH)2在pH=12的D(NaOH)溶液中Mg2+的浓度为1.8×10﹣7mol/L,c(OH﹣)=10﹣2mol/L,Mg(OH)2(s)⇌Mg2++2OH﹣依据溶度积常数计算得到Ksp=c(Mg2+)c2(OH﹣)=1.8×10﹣7mol/L×(10﹣2mol/L)2=1.8×10﹣11(mol/L)3
故答案为:1.8×10﹣11(mol/L)3;
点评:
本题考查电解质溶液之间的反应,沉淀溶解平衡的溶度积计算,涉及到强电解质、弱电解质的电离、盐类的水解及溶液的pH值、离子浓度大小的比较等知识.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
在一定条件下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g)═2CO2(g)△H=﹣566kJ•mol﹣1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1
由1mol CO(g)和3mol CH4(g)组成的混合气体在上述条件下充分燃烧,恢复至室温释放的热量为( )
|
| A. | 2912kJ | B. | 2953kJ | C. | 3236kJ | D. | 3867kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用CO生产甲醇的反应为CO(g)+2H2(g)⇌CH3OH(g).图10表示反应中能量的变化;图11表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图.下列叙述错误的是( )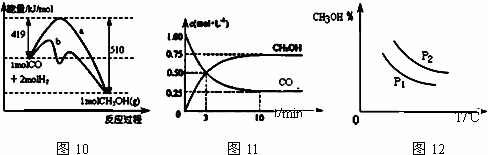
|
| A. | CO和H2合成CH3OH的反应:△H<0,△S>0 |
|
| B. | 保持温度不变,再充入1mol CO和2mol H2,反应达到新平衡时 |
|
| C. | 图10中曲线b可表示使用了催化剂的能量变化情况 |
|
| D. | 图12中曲线可表示在不同压强P1、P2(P1<P2)条件下甲醇百分含量随温度变化的情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:
摩尔浓度相同的三种盐NaX、NaY和NaZ的溶液,其中pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
|
| A. | HX、HZ、HY | B. | HZ、HY、HX | C. | HX、HY、HZ | D. | HY、HZ、HX |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定的溶液中能大量共存的是( )
①无色溶液中:K+、Cu2+、Na+、SO42﹣
②常温下pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、NO3﹣、NH4+
④在由水电离出的c(OH﹣)=10﹣13 mol•L﹣1的溶液中:Na+、Ba2+、Cl﹣、I﹣
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Al3+、Cl﹣、S2﹣
⑥使pH试纸呈红色的溶液中:Fe2+、Al3+、NO3﹣、Cl﹣.
|
| A. | ②④ | B. | ③⑤ | C. | ④⑥ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于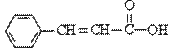 的下列说法中正确的是
的下列说法中正确的是
A.分子式为C9H9O2
B.含有三种官能团
C.可使溴的四氯化碳溶液或酸性KMnO4溶液褪色
D.可以发生取代反应和加成反应,但不能发生聚合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2 (g) △H = + 131.3 kJ • mol﹣1, △S = +133.7 J∙K﹣1•mol﹣1
CO(g)+H2 (g) △H = + 131.3 kJ • mol﹣1, △S = +133.7 J∙K﹣1•mol﹣1
①该反应能否自发进行与___________有关。
②一定温度下,在一个容积可变的密闭容器中, 发生上述反应,下列能判断该反应达到化学平衡状态的是___________(填字母)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O CO2(g)+H2 (g),得到如下三组数据:
CO2(g)+H2 (g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1中以v(CO2)表示的反应速率为__________。
②该反应的逆反应为__________(填”吸”或”放”)热反应。
③若使实验3达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min, 则a、b应满足的关系是______________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+ H2O(g),如图表示该反应进行过程中能量(单位为kJ • mol﹣1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2 ,下列措施中能使c(CH3OH)增大的是__________。
CH3OH(g)+ H2O(g),如图表示该反应进行过程中能量(单位为kJ • mol﹣1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2 ,下列措施中能使c(CH3OH)增大的是__________。
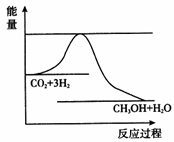
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
六氟化硫(SF6)具有良好的高压绝缘性,在电器工业中有着广泛的用途,SF6分子呈正八面体结构,S 原子位于正八面体的中心。下列关于SF6的推测中,正确的是
A.SF6在氧气中燃烧可生成SO2
B.SF6晶体是原子晶体
C.SF6是非极性分子
D.SF6中各原子的最外电子层都达到8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机化合物的叙述中正确的是( )
|
| A. | 糖类、蛋白质是高分子化合物,适当的条件下可以发生水解反应 |
|
| B. | 甲烷和氯气光照条件下发生取代反应,产物是气体与液体混合物 |
|
| C. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
|
| D. | 乙醇与乙酸不能混合,因为二者可以马上生成乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com