
【题目】亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。
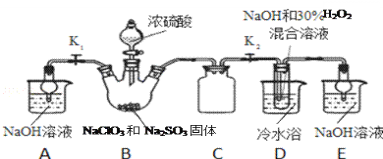
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为___________;装置D中反应生成NaClO2的化学方程式为________________________;
(2)装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还肯定含有的一种阴离子是________________;检验该离子的方法是________________________;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②__________;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是________________________;
实验Ⅱ:样品杂质分析与纯度测定
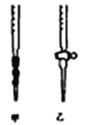
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c molL﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL
①用Na2S2O3标准溶液滴定时,应将Na2S2O3标准溶液注入________(填“甲”或“乙”)中。
②观察Na2S2O3标准溶液滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致待测溶液浓度测定值___________(选填“偏大”“偏小”或“无影响”)。
③(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为________。
【答案】2NaClO3 +Na2SO3 + H2SO4= 2 ClO2↑+2Na2SO4+ H2O 2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 SO42﹣ 取少量反应后的溶液于试管中,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42﹣ 趁热过滤 NaClO3和NaCl 甲 偏小 cV10﹣3mol
【解析】
装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,装置C为安全瓶,装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,装置E为吸收多余的气体,防止污染空气,装置A是吸收B中剩余气体。
(1)装置B中的产物有ClO2气体,则氯酸钠被还原,所以亚硫酸钠被氧化为硫酸钠,方程式为2NaClO3 +Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;装置D中二氧化氯、氢氧化钠、过氧化氢反应生成NaClO2的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;答案为:2NaClO3 +Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(2)B中生成二氧化氯,则氯酸钠被还原,所以亚硫酸钠被氧化为硫酸钠,且B中还加了浓硫酸,所以D反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH-外还肯定含有的一种阴离子是SO42-;检验该离子的方法是取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42﹣;答案为:SO42﹣;取少量反应后的溶液于试管中,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42﹣;
(3)根据题中信息可知,NaClO2饱和溶液在低于38℃时析出NaClO23H2O,,高于38℃时析出NaClO2,高于60℃时NaClO2分解,故应趁热过滤,答案为:趁热过滤;
(4)使用冷水浴,说明D中的反应是放热反应。如果撤去D中的冷水浴,温度可能会高于60℃,则NaClO2分解成NaClO3和NaCl,可能导致产品中混有的杂质是NaClO3和NaCl;答案为:NaClO3和NaCl;
(5)①Na2S2O3溶液,因水解显碱性,则用碱式滴定管,使用甲装置;②若滴定前仰视,读数偏大;滴定后俯视,读数偏小,两次读数使标准液的实际体积大于读数体积,导致待测液浓度偏小;③I2+2S2O32﹣=2I﹣+S4O62﹣,n(S2O32﹣)=cmol/L![]() V mL=2n(I2)=4n(ClO2﹣),则25mL溶液中含有n(NaClO2)=
V mL=2n(I2)=4n(ClO2﹣),则25mL溶液中含有n(NaClO2)=![]() c
c![]() V
V![]() 10-3mol,100mL溶液含有n(NaClO2)=c
10-3mol,100mL溶液含有n(NaClO2)=c![]() V
V![]() 10-3mol;答案为:甲;偏小;c
10-3mol;答案为:甲;偏小;c![]() V
V![]() 10-3mol;
10-3mol;


科目:高中化学 来源: 题型:
【题目】把A、B、C、D四块金属片浸入稀硫酸中,分别用导线两两相连可以组成原电池。A、B相连时A为负极;C、D相连时,电流由D→C;A、C相连时,C极上产生大量气泡,B、D相连时,D极发生氧化反应。这四种金属的活动性顺序是
A.A>B>C>DB.A>C>D>BC.C>A>B>DD.B>D>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)===CO2(g)+3H2(g)。下图是该反应的能量变化图:

①通过图中信息可判断反应CH3OH(g)+H2O(g)===CO2(g)+3H2(g)的ΔH________0(选填“>”“=”或“<”)。
②图中途径(Ⅱ)的条件是__________________,途径(Ⅰ)的反应热________途径(Ⅱ)的反应热(选填“>”“=”或“<”)。
③在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为__________________________________________。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)===H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去)。

(1)配制氯化铁溶液时,需先把氯化铁晶体溶解在______中,再加水稀释,这样操作的目的是__________________________________________。
(2)通入足量SO2时,装置C中观察到的现象为___________________________________。
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式____________________________________;
②请设计实验方案检验有Fe2+ 生成___________________________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42 -,该做法____(填“合理”或“不合理”),理由是__________。
(4)D装置中倒置漏斗的作用是_________________________________________________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有____________(填字母)。
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分为Al2O3和SiO2,还含有少量的FeO、Fe2O3等)为原料制备Al2O3的流程如下:

(1)“酸浸”时需加入过量的稀硫酸,目的是提高浸取率和________;滤渣的主要成分是__________。
(2)“氧化”过程中,加入H2O2发生反应的离子方程式为____________。
(3)“提纯”过程中,当加入NaOH溶液达到沉淀量最大时,溶液中c(SO42-)∶c(Na+)=_________。
(4)已知Ksp[Fe(OH)3]=1×10-39。“提纯”过程中,当c(Fe3+)<10-6 mol ·L-1时,溶液中c(OH-)>________mol ·L-1。
(5)“沉淀”过程中,通入过量CO2时发生反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,还原产物是____________。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________价。
②以上反应中的氧化剂为________,当有1 mol CuI参与反应时,转移电子________mol。
③标明上述反应电子转移的方向和数目。____________________________。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4—+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4—+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:______,MnO![]() +Fe2++H+=Mn2++Fe3++H2O
+Fe2++H+=Mn2++Fe3++H2O
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com