
【题目】下列各组指定原子序数的元素,不能形成AB2型离子化合物的是( )
A. 6和8B. 12和9C. 12和17D. 20和17
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用NA代表阿伏伽德罗常数,下列说法正确的是( )
A.相同质量的铝,分别与足量的盐酸和氢氧化钠溶液反应放出的氢气体积一定不相同
B.56gFe与足量盐酸反应转移电子数为3NA
C.任何条件下,22.4LNH3与18gH2O所含电子数均为10NA
D.46gNO2和N2O4的混合物含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3 , 不考虑其他杂质)制取七水合硫酸亚铁(FeSO47H2O),设计了如图流程:下列说法不正确的是( ) 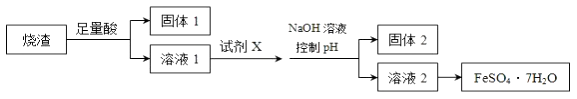
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2 , 控制pH为使Al3+转化为Al(OH)3 , 进入固体2
C.从溶液2得到FeSO47H2O产品的过程中,须控制条件防止其氧化
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO47H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AgNO3、Cu(NO3)2和Zn(NO3)2混合溶液中,加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,有气体产生。则下列结论正确的是
A. 滤液中一定有Fe(NO3)3
B. 滤渣只含Ag和Cu,一定无Zn
C. 滤渣中一定有Ag、Cu和Fe,一定无Zn
D. 滤渣中一定有Ag、Cu、Fe和Zn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜矿主要含Cu2(OH)2CO3 , 还含少量Fe、Si的化合物.实验室以此铜矿石为原料制备CuSO45H2O及CaCO3 , 部分步骤如图: 
请回答下列问题:
(1)溶液A除含有Cu2+外,还可能含有的金属离子有(填离子符号);验证所含离子所用的试剂是在 .
(2)可用生成的CO2制取优质碳酸钙.制备时,先向氯化钙溶液中通入氨气,再通入CO2 .
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气.某学习小组选取图1所给部分装置制取并收集纯净的氨气.
如果按气流方向连接各仪器接口,你认为正确的顺序为a→、→、→i.
其中与i相连漏斗的作用是 .
②为探究氨气和氯气的反应(图2)
a.装置A、B,B装置内的药品依次是、 .
b.装置C可用于探究氯气与氨气(已知氯气和氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应.实验打开开关1、3,关闭2,先向烧瓶中通入 , 然后关闭1、3,打开2,向烧瓶中缓缓通入一定量的另一种气体.实验一段时间后向烧瓶内出现浓厚的白烟并在容器内壁凝结.
(3)测定铜矿石中Cu2(OH)2CO3质量百分含量的方法是:
a.将1.25g铜矿石制取的CuSO45H2O于锥形瓶中,加入适量水完全溶解;
b.向溶液中加入100mL0.25mol/L的氢氧化钠溶液使Cu2+完全沉淀;
c.过滤;
d.滤液中的氢氧化钠溶液用0.5mol/L盐酸滴定至终点,耗用10mL盐酸.则铜矿石中Cu2(OH)2CO3质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题进行计算:
(1)32g铜投入一定浓度的硝酸溶液中,铜完全溶解,共收集到NO和NO2的混合气体8.96L气体(标准状况). ①计算产生NO的体积(标准状况)L
②将盛有此混合气体的容器倒扣在水中,通入标准状况下一定体积的O2 , 恰好使气体完全溶于水中,则通入O2的体积为L.
(2)向100mL 0.8mol/L硝酸溶液中加入一定量Fe、FeO、Fe2O3的混合物,充分反应后,放出标准状况下的气体224mL,且测得溶液中铁只以Fe2+形式存在,为使Fe2+完全沉淀,可向反应后的溶液中加入0.1mol/L的NaOH溶液mL.
(3)若将(2)中硝酸换为盐酸,其他均不变,则所需NaOH溶液的体积为mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉遇到碘单质,可以出现明显的蓝色特征。现将淀粉和稀Na2SO4溶液混合,装在半透膜中,浸泡在盛蒸馏水的烧杯内,过一段时间后,取烧杯中液体进行实验,能证明半透膜完好无损的是
A.加入BaCl2溶液产生白色沉淀 B.加入碘水不变蓝
C.加入BaCl2 溶液没有白色沉淀产生 D.加入碘水变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿的主要成分是CuFeS2(硫元素﹣2价,铁元素+2价).实验室用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如图: 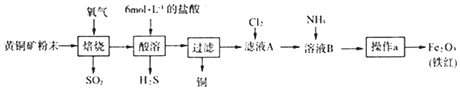
已知:CuFeS2+O2 ![]() Cu+FeS+SO2 FeS+2HCl=FeCl2+H2S↑
Cu+FeS+SO2 FeS+2HCl=FeCl2+H2S↑
(1)实验室制氯气的化学方程式为 .
(2)SO2和H2S有毒,会造成大气污染.
①已知SO2和H2S混合可以得到单质硫.为使SO2和H2S恰好完全转化为硫,二者体积(标准状况)比应为 .
为检验某尾气中是否含有SO2、CO2、CO三种气体,实验小组同学用如下装置设计实验.
选择上述装置(可以重复),按照气流方向其连接顺序为A→(填序号).
(3)PbO2具有强氧化性,可与浓盐酸反应制取氯气.
①上述反应化学方程式为;由PbO与次氯酸钠溶液反应可制得PbO2 , 反应的离子方程式为 .
②Cl2是纺织工业中常用的漂白剂,Na2S2O3可作漂白布匹后的“脱氯剂”.Na2S2O3在溶液中被Cl2氧化成SO42﹣ , 则该反应的化学方程式为 .
③本实验存在的一个缺陷是 .
(4)按上述流程用150g黄铜矿粉末可制得48gFe2O3(铁红),则该黄铜矿中含CuFeS2的质量分数是(假设各步反应均完全进行且过程中无额外物质损耗).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图1所示装置进行实验,请回答下列问题: 
(1)若开始实验时开关K与a连接,则B极的电极反应式为 .
(2)若开始实验时开关K与b连接,则下列说法正确的是(填序号). ①溶液中Na+向A极移动
②从A极逸出的气体能使湿润的淀粉KI试纸变蓝
③反应一段时间后向电解液中加适量盐酸可恢复到电解前的浓度
(3)该小组运用工业上离子交换膜法制烧碱的原理,用如图2所示装置电解K2SO4溶液. ①该电解槽的阳极反应式为 , 通过阴离子交换膜的离子数(填“>”、“<”或“=”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为;
③电解一段时间后,B口与C口产生气体的质量比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com