

| A. | 原溶液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 原溶液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |
分析 某强酸性溶液中CO32-不存在,Fe2+和NO3-不能同时存在,试液中加入过量硝酸钡溶液,生成气体证明一定含有Fe2+、则原溶液中一定不存在NO3-,气体为NO,沉淀A为BaSO4,原溶液中一定不存在Ba2+,一定存在SO42-,溶液A中加入过量氢氧化钠溶液生成气体B为NH3,确定原溶液中含有NH4+,沉淀B为Fe(OH)3,由于溶液B中含有Ba2+,OH-,溶液B加入少量二氧化碳发生反应③,生成的沉淀一定含有BaCO3沉淀,可能生成沉淀Al(OH)3,溶液B中不一定含有AlO2-,则原溶液中不一定含有Al3+,
A、原溶液中一定有Fe2+、SO42-、H+、NH4+,铝离子可能含有;
B、上述分析可知,原溶液中一定没有Ba2+、CO32-、NO3-;
C、步骤③中反应的离子方程式可能为Ba2++2OH-+CO2=BaCO3↓+H2O,或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
D、气体A为NO,气体B为NH3,二者之间能发生反应.
解答 解:某强酸性溶液中CO32-不存在,Fe2+和NO3-不能同时存在,试液中加入过量硝酸钡溶液,生成气体证明一定含有Fe2+、则原溶液中一定不存在NO3-,气体为NO,沉淀A为BaSO4,原溶液中一定不存在Ba2+,一定存在SO42-,溶液A中加入过量氢氧化钠溶液生成气体B为NH3,确定原溶液中含有NH4+,沉淀B为Fe(OH)3,由于溶液B中含有Ba2+,OH-,溶液B加入少量二氧化碳发生反应③,生成的沉淀一定含有BaCO3沉淀,可能生成沉淀Al(OH)3,溶液B中不一定含有AlO2-,则原溶液中不一定含有Al3+;
A、原溶液中一定有Fe2+、SO42-、H+、NH4+,铝离子不一定含有,故A错误;
B、上述分析可知,原溶液中一定没有的离子为:Ba2+、CO32-、NO3-,故B正确;
C、步骤③中反应的离子方程式可能为Ba2++2OH-+CO2=BaCO3↓+H2O,或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,故C错误;
D、气体A为NO,气体B为NH3,二者之间能发生氧化还原反应,故D错误;
故选B.
点评 本题考查了物质性质的分析应用,主要是离子性质的过程分析,离子存在和现象的理解应用是解题关键,题目难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | 方法 | |
| A | 甲烷 | 乙烯 | 酸性高锰酸钾溶液 | 洗气 |
| B | 氯化亚铁溶液 | 氯化铁 | 过量铁粉 | 过滤 |
| C | 苯 | 溴 | 足量NaI溶液 | 分液 |
| D | 乙酸乙酯 | 乙酸 | 饱和碳酸钠溶液 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 温度/℃ | 250 | 350 |
| K | 2.041 | x |
| c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 | |
| 0min | 0.8mol•L-1 | 1.6mol•L-1 | 0 |
| 2min | 0.6mol•L-1 | y | 0.2mol•L-1 |
| 4min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
| 6min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥⑦ | B. | ③④⑥ | C. | ②④⑤⑧ | D. | ①③④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;
(1)有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
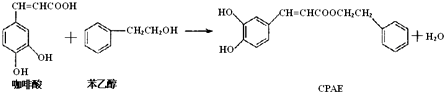
| A. | 咖啡酸分子中所有原子可能处在同一个平面上 | |
| B. | 1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH | |
| C. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| D. | 1 mol 苯乙醇在O2中完全燃烧,需消耗10 mol O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com