
【题目】硫酸、硝酸和盐酸既是重要的化工原料也是化学实验室里必备的试剂.
(1)常温下,可用铝槽车装运浓硫酸,这是因为浓硫酸具有性;硝酸应保存在棕色试剂瓶中,这是因为硝酸具有性;敞口放置的浓盐酸浓度会减小,这是因为盐酸具有性.
(2)①在100mL 18molL﹣1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积为13.44L,则参加反应的铜片的质量为(选填序号);
a.115.2g b.76.8g c.57.6g d.38.4g
②若使上述①中反应剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式: .
(3)工业制盐酸是以电解饱和氯化钠溶液为基础进行的,该电解过程中阳极的电极反应式为: .
【答案】
(1)强氧化;不稳定;挥发
(2)d;3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O
(3)2Cl﹣﹣2e﹣=Cl2↑
【解析】解:(1)浓硫酸具有强氧化性,可使铝钝化,则常温下可用铝槽车装运浓硫酸;浓硝酸不稳定,易分解,应保存在棕色试剂瓶中;盐酸易挥发,敞口放置的浓盐酸浓度会减小,所以答案是:强氧化;不稳定;挥发;(2)①铜只能和浓硫酸反应,和稀硫酸不反应,Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+H2O,n(SO2)=
CuSO4+SO2↑+H2O,n(SO2)= ![]() =0.6mol,则由方程式可知消耗的铜的质量为0.6mol×64g/mol=38.4g,所以答案是:d;②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,加入硝酸钠提供硝酸根离子和溶液中的氢离子形成稀硝酸,稀硝酸可以继续溶解铜,反应的离子方程式为:3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O,所以答案是:3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O;(3)电解时,阳极发生氧化反应,生成氯气,电极方程式为2Cl﹣﹣2e﹣=Cl2↑,所以答案是:2Cl﹣﹣2e﹣=Cl2↑.
=0.6mol,则由方程式可知消耗的铜的质量为0.6mol×64g/mol=38.4g,所以答案是:d;②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,加入硝酸钠提供硝酸根离子和溶液中的氢离子形成稀硝酸,稀硝酸可以继续溶解铜,反应的离子方程式为:3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O,所以答案是:3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O;(3)电解时,阳极发生氧化反应,生成氯气,电极方程式为2Cl﹣﹣2e﹣=Cl2↑,所以答案是:2Cl﹣﹣2e﹣=Cl2↑.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6 L的气体。该合金中铝、铁的物质的量之比为( )
A.1∶1
B.2∶5
C.3∶2
D.3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C三种烃,已知:
①B完全燃烧的产物n(CO2):n(H2O)=2:3.
②C为饱和链烃,通常状况下呈气态,其二氯代物有三种.
③A是B分子中的氢原子全部被C分子中的最简单的烃基取代的产物;A遇Br2的CCl4溶液不褪色,其一氯代物只有一种.
试回答下列问题:
(1)B的分子式 , 二溴代物有种.
(2)C的三种二氯代物的结构简式为、  、 .
、 .
(3)A的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动小组利用下图装置验证NO的还原性及探究工业生产硝酸的原理. 
(1)如何检查该装置气密性 .
(2)向广口瓶①中通入NO并测定NO的体积
通入NO前,向广口瓶①中加入水,让水充满广口瓶①,且调节滴定管中液面与①相平并记录滴定管的刻度.
从导管a通入一定量的NO并准确测定通入NO的体积的主要操作:;计算出通入的NO的体积为VmL(V<50mL).
(3)验证NO的还原性;探究工业生产硝酸的原理
A、停止通入NO后关闭K1、K3 , 打开K2 , 从导管b缓缓通入O2 , 写出通入O2过程中发生的化学反应方程式;
B、继续通入O2 , 打开K3并及时调整滴定管③液面与广口瓶①中液面相平.
Ⅰ.当通入氧气的体积为 ![]() 时,则广口瓶①的气体体积为;
时,则广口瓶①的气体体积为;
Ⅱ.当广口瓶①的气体体积为 ![]() ,则通入氧气的体积可能为 .
,则通入氧气的体积可能为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源. 
(1)黄铁矿在空气中易被氧化,其反应历程可能为如图1所示的四步: ①a反应中每生成1molFeSO4转移电子的物质的量为mol.
②d反应的离子方程式为 .
(2)用黄铜矿常温细菌冶铜和高温火法冶铜的流程如图2所示: ①细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高Cu2+的浸出速率,
其原理如图3所示:
Ⅰ.冶炼过程中,FeS2周边溶液的pH(填“增大”、“减小”或“不变”).
Ⅱ.从CuFeS2析出S的反应式是 .
②火法冶铜时,由Cu2S制得铜的化学方程式是 .
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数与温度的关系如图4.
相关反应 | 反应热 | 平衡常数 |
FeS2(s)+H2(g)FeS(s)+H2S(g) | △H1 | K1 |
| △H2 | K2 |
FeS(s)+H2(g)Fe(s)+H2S(g) | △H3 | K3 |
①上述反应中,△H10(填“>”或“<”).
②提高硫的脱除率可采取的措施有(举1例).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《电石安全技术说明书》中对电石的描述为“…遇水或湿气能迅速产生高度易燃的乙炔气体,应与氧化剂类物质分开存放…”.下列说法不合理的是( ) 
A.盛装电石的包装上贴有的危险化学品标志为:
B.电石与硝酸分开存放
C.运输电石的铁桶内可充入氮气
D.电石着火可用泡沫灭火器扑灭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图装置探究SO2的性质. 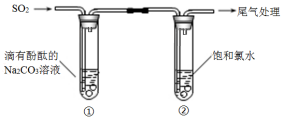
下列有关反应的方程式,不正确的是( )
A.①中溶液显红色的原因:CO32﹣+H2OHCO3﹣+OH﹣
B.①中溶液红色褪去的原因:2SO2+CO32﹣+H2O═CO2+2HSO3﹣
C.②中溶液显黄绿色的原因:Cl2+H2O═HCl+HClO
D.②中溶液黄绿色褪去的原因:SO2+Cl2+2H2O═H2SO4+2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组用如图装置进行实验,下列说法正确的是( ) 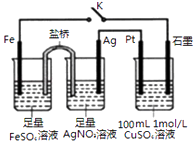
A.盐桥中的电解质可以用KC1
B.闭合K,石墨电极上只生成铜
C.当有0.1mol Fe溶解时,流经电解液的电子个数为1.204×1023
D.导线中流过0.3mol电子时,加入11.1gCu2(OH)2CO3 , CuSO4溶液可恢复原组成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com