
| 实验 | A | B | C | D | E | F | |
| 混 合 溶 液 | 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 | |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 | |
| 时间(min) | 15 | 10 | 5 | 3 | 6 | 9 | |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| , |
分析 (1)锌较活泼,可与硫酸铜、硫酸等发生置换反应;
(2)①为保证实验有对比性,只能逐渐改变一个变量分析,CuSO4溶液体积逐渐增多,故H2SO4的量应相等均为30mL,水的量减小,但每组实验中CuSO4与水的体积之和应相等;
②生成的单质Cu会沉积在Zn的表面,影响了反应速率;
(3)Zn置换出Cu,固体中一定有Cu,也可能有剩余的Zn,根据逻辑推理,假设2为Zn和Cu混合物;
(4)根据铜的金属活动性,不能置换出氢气,加入稀盐酸,如无气泡产生,则假设1成立;反之,不成立.
解答 解:(1)因为Cu2+的氧化性比H+的强,所以加入硫酸铜,Zn先跟硫酸铜反应,反应完后再与酸反应,反应的有关方程式为Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)锌为活泼金属,加入硫酸铜,发生Zn+CuSO4=ZnSO4+Cu,置换出铜,与锌形成原电池反应,化学反应速率加快,
故答案为:CuSO4与Zn反应产生的Cu与Zn形成CuZn微电池,加快了氢气产生的速率;
(2)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml.而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V6=10ml,V9=17.5ml,V1=30ml.
故答案为:30;10;17.5;
②因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降,
故答案为:当加入一定量的硫酸铜后,生成的单质铜会沉积在Zn表面,降低了Zn与溶液接触的表面,使得氢气的生成速率反而下降;
(3)Zn置换出Cu,固体中一定有Cu,也可能有剩余的Zn;
故答案为:既有Zn又有Cu;
(4)根据铜的金属活动性,不能置换出氢气,加入稀盐酸,如无气泡产生,则假设1成立;反之,不成立;
故答案为:
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 取少量固体于试管中,滴加适量稀盐酸 | 若有气泡产生,假设1不成立; 若无气泡产生,假设2成立. |
点评 本题考查了影响化学反应速率的因素,并且融合了化学实验,形式新颖灵活,本题的易错点在于第(2)小题,首先V1、V6、V9的求得要注意分析表中数据;题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
.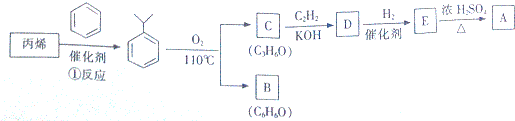
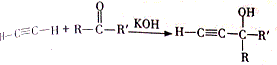
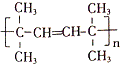 ,该反应的类型是加聚反应;B遇FeCl3溶液显紫色,B的名称是苯酚.
,该反应的类型是加聚反应;B遇FeCl3溶液显紫色,B的名称是苯酚.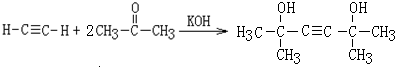 .
.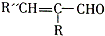 +H2O
+H2O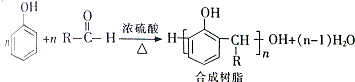
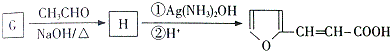
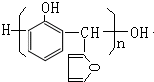 .
.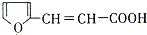 的所有同分异构体的结构简式
的所有同分异构体的结构简式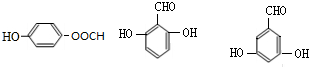 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
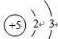 ,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.
,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 2.7 | 5.0 | 8.7 | 14.8 | 23.8 |
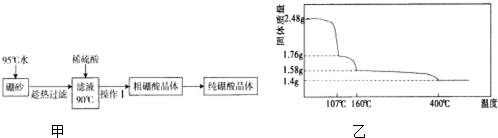
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
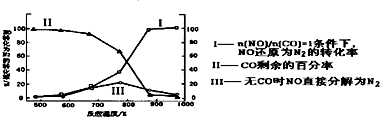
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 内容 | 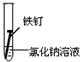 | 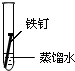 | 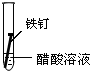 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑦ | B. | ②④⑥⑦ | C. | ①⑤⑥⑦ | D. | ②④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | ||
| T |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 含Z元素的弱酸不能与含W元素的弱酸反应得到强酸 | |
| D. | T元素形成的酸与W元素形成的酸相比,酸性一定后者弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用活性炭去除汽车内室的异味 | |
| B. | 用硝酸对钢船舱进行钝化处理 | |
| C. | 用经硫酸酸化处理的三氧化铬硅胶检验酒精 | |
| D. | 用小苏打溶水拌入面中一起蒸煮使馒头蓬松 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com