
| A. | 一定显酸性 | B. | 一定显碱性 | ||
| C. | 一定显中性 | D. | 可能显酸性、碱性或中性 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液盛装在用玻璃塞的试剂瓶中 | |
| B. | 氢氟酸盛装在玻璃瓶中 | |
| C. | 金属钠保存在煤油中 | |
| D. | 硝酸银固体存放在细口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②⑤③⑥ | B. | ④①②⑤③⑥ | C. | ⑤②④①③⑥ | D. | ⑤②④③①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在酸性土地中 | |
| B. | 在潮湿疏松的土壤中 | |
| C. | 在干燥致密不透气的土壤中 | |
| D. | 在含碳粒较多,潮湿透气的中性土壤中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 钠与硫酸铜溶液反应:2Na+Cu2+═Cu+2Na+ | |
| C. | 过量铁与稀硝酸反应:3Fe+8H++2NO3-═3Fe2++4H2O+2NO↑ | |
| D. | 等物质的量的Ba(OH)2与NaHSO4在溶液中反应:Ba2++OH-+HSO4-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、Br-、CO32- | B. | K+、Na+、SO32-、MnO4- | ||
| C. | Al3+、Na+、AlO2-、Cl- | D. | Na+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 NH4NO3溶液中:c(NH4+)>c(NO3-)>c(H+)>c(OH-) | |
| B. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 向10 mL 0.2 mol•L-1 NaCl溶液中滴入2 mL 0.1 mol•L-1 AgNO3溶液,溶液中离子浓度大小关系:c(Na+)>c(NO3-)=c(Cl-)>c(Ag+) | |
| D. | 常温下pH=2的醋酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
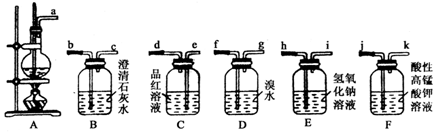
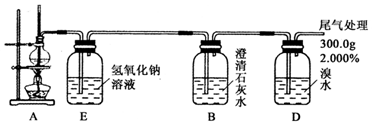
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com