
| A. | 5mol/L | B. | 1.25mol/L | C. | 2.5mol/L | D. | 3mol/L |
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2溶于水形成碳酸,SiO2难溶于水 | |
| B. | CO2通入Na2SiO3稀溶液中,生成白色胶状沉淀硅酸 | |
| C. | 高温下SiO2与碳酸盐反应生成CO2 | |
| D. | HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
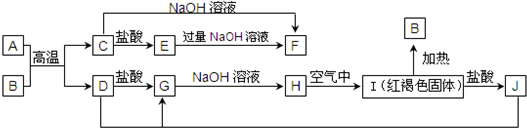
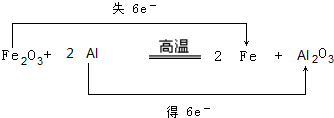 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沱牌舍得酒标签注有“酒精度53%Vol”字样,它表示100g该白酒中含有53g,酒精 | |
| B. | 食盐可作调味剂,也可作食品防腐剂 | |
| C. | 碘是人体必须微量元素,所以要多吃富含高碘酸的食物 | |
| D. | “温室效应”、“酸雨”的形成都与氮氧化合物有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入盐酸酸化的硝酸钡溶液 | B. | 在AlCl3溶液中滴入过量的氨水 | ||
| C. | 在空气中长期存放的漂白粉溶液 | D. | 将少量NaAlO2投入盐酸中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com