
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①C6H5Cl ②(CH3)2CHCH2Cl ③(CH3)3CCH2Cl ④CHCl2﹣CHBr2 ⑤ ![]() ⑥CH2Cl2 .
⑥CH2Cl2 .
A.①③⑥
B.②③⑤
C.全部
D.②④
【答案】A
【解析】解:①有机物发生消去反应发生后将会形成不饱和键,而氯苯中相邻的碳原子是苯环的一部分,没有氢原子,故不能发生消去反应,故①正确;
②和氯相连的碳的相邻碳原子上有氢,故能消去,生成对应的烯烃和氯化钾,故②错误;
③和氯相连的碳的相邻碳原子上没有氢,所以不能发生消去反应.故③正确;
④和氯或溴相连的碳相邻碳原子上有氢,故能消去,生成对应的烯烃或炔烃和氯化钾,故④错误;
⑤和溴相连的碳上有氢,故能发生消去反应,生成对应的烯烃和溴化钾,故⑤错误;
⑥二氯甲烷只有一个碳,没有相邻的碳,所以不能发生消去反应.故⑥正确;
故选A.
消去反应是指在一定条件下,有机物脱去小分子生成含有不饱和键的有机物.卤代烃的消去反应是在碱的醇溶液中加热,连接﹣X的碳的相邻碳原子上的一个H和﹣X一同被脱去,而生成不饱和烃和卤化氢.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】我国科研人员以传统中药为原料先制得化合物I,再转化为具有抗癌抑菌活性的化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是( ) 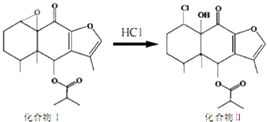
A.化合物I分子式为C19H24O5
B.化合物I 和Ⅱ均能与酸性KMnO4溶液和NaOH溶液反应
C.化合物Ⅱ一定条件下能发生取代、消去及加成反应
D.检验化合物Ⅱ中是否含化合物I可用Br2的CCl4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫醉钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂.硫代硫酸钠(Na2S203)可由亚硫酸钠和硫粉通过化合反应制得,装置如图I所示.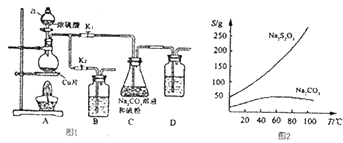
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示.
(1)Na2S2O35H2O的制备:
步骤1:如图连接好装置后(未装药品),检查A、C装且气密性的操作是_ .
步骤2:加人药品,打开K1、关闭K2、加热.装置B、D中的药品可选用下列物质中的(填编号).
A.NaOH溶液 B.浓H2SO4C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的最逐渐减少.
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液过滤、洗涤、烘干,得到产品.
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式 .
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加人足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时Cr42﹣全部转化为Cr2O72﹣;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010molL﹣1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00mL.部分反应的离子方程式为:Cr2O72﹣+6I﹣+14H+═2Cr3++3I2+7H2O.I2+2S2O32﹣═S4O62﹣+2I﹣ , 则该废水中Ba2+的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员以传统中药为原料先制得化合物I,再转化为具有抗癌抑菌活性的化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是( ) 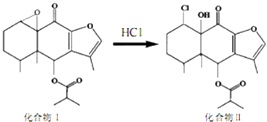
A.化合物I分子式为C19H24O5
B.化合物I 和Ⅱ均能与酸性KMnO4溶液和NaOH溶液反应
C.化合物Ⅱ一定条件下能发生取代、消去及加成反应
D.检验化合物Ⅱ中是否含化合物I可用Br2的CCl4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是模拟“侯氏制碱法”制取NaHCO3的部分装置.下列操作正确的是( ) 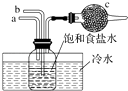
A.a通入CO2 , 然后b通入NH3 , c中放碱石灰
B.a通入NH3 , 然后b入CO2 , c中放蘸稀硫酸的脱脂棉
C.b通入NH3 , 然后a通入CO2 , c中放碱石灰
D.b通入CO2 , 然后a通入NH3 , c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,每种物质都能被氧化又能被还原的是( )
A.F2、Cl2、CuSO4B.Cl2、Al、H2C.H2S、HCl、H2O2D.F2、K、HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘元素,某学习小组设计如下实验流程提取海带中的碘,请回答下列问题:
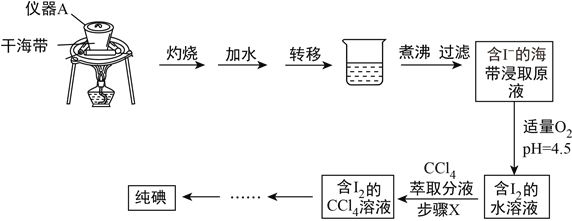
(1)仪器A的名称为__________________,实验室取用仪器A必须使用_________。
(2)煮沸的作用是______________________。
(3)步骤X中,使用了分液漏斗。分液漏斗使用前,须进行的操作是__________;萃取后,分液漏斗内观察到的现象是___________;分液时,为了保证液体顺利留下,应首先_________。
(4)向海带浸取原液中通入适量O2,并控制溶液pH为4.5,此时发生反应的离子反应方程式为:__________________________________________。
(5)某同学欲采用蒸馏含I2的CCl4溶液得到纯碘,此方案不合理,理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用托盘天平称量镁粉25.2g(1g以下用游码),他把镁粉放在右盘,当天平平衡时,所称取的镁粉的实际质量是
A. 25.2g B. 24.8g C. 24.2g D. 26.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前从海水中提取的溴占世界溴年产量的三分之一左右,常用的方法之一是用氧化剂把溴离子氧化成单质,再通入热空气将溴蒸气吹出,这一反应中常用的氧化剂是( )。
A. Cl2B. Br2C. H2OD. H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com