
| A.硫酸钠、硫化钠、亚硫酸钾、硫代硫酸钾、偏铝酸钠 |
| B.氯化铁、氯化铵、硫酸钠、硫酸镁、硫酸铝 |
| C.硫氰化钾、氯化钾、苯酚、硫酸钠、碳酸钠 |
| D.氯化铝、盐酸、氯化钠、氯化钡、氢氧化钠 |


科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①③ | C.②④ | D.①③⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体, | |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.沉淀X的成分是SiO2 |
| B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3 |
| C.在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2 |
| D.溶液Y中的阳离子主要是Mg2+.Al3+.Fe3+.H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 选项 | 实验操作 | 实验目的或结论 | 判断 |
| ① | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 说明该钾盐是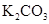 | |
| ② | 向某溶液中加入盐酸,无明显现象,再向其中加入BaCl2溶液有白色淀沉淀产生 | 证明该溶液中有 SO42— | |
| ③ | 向淀粉溶液中加入一定量的稀硫酸加热,再加入一定量的新制氢氧化铜加热。 | 证明淀粉水解产生葡萄糖 | |
| ④ | 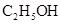 与浓硫酸170℃共热,制得的气体通人酸性 与浓硫酸170℃共热,制得的气体通人酸性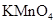 溶液 溶液 | 检验制得气体是否为乙烯 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去乙醇中混有的乙酸:加入氢氧化钠溶液分液 |
| B.除去混在CO2中的SO2:将气体通过饱和碳酸钠溶液洗气 |
| C.除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤 |
| D.除去混在CO2中的CO:将气体通过装有灼热氧化铜的加热管 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
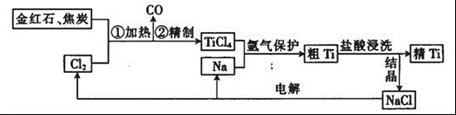


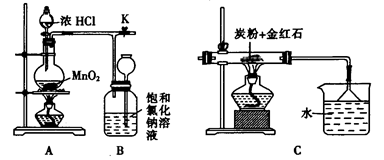
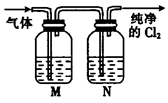
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
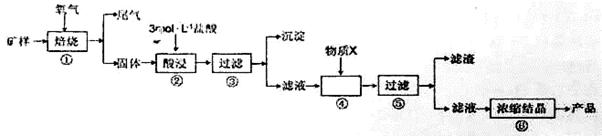
| 金属离子 | 氢氧化物开始沉淀的pH | 氢氧化物沉淀完全的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com