
| A. | 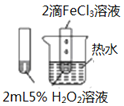 图验证FeCl3对H2O2分解反应有催化作用 | |
| B. | 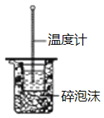 图用于中和热的测定 | |
| C. | 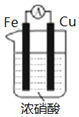 图用于探究Cu作负极的原电池原理 | |
| D. |  图用于比较盐酸、碳酸、硅酸的酸性 |
分析 A.验证催化剂对反应速率的影响时,除了催化剂因素不同外,其它条件必须相同;
B.中和热测定中需要用环形玻璃搅拌棒搅拌;
C.铁与浓硝酸发生钝化,该装置中铜为负值;
D.浓盐酸易挥发,挥发出的HCl能够与硅酸钠反应,干扰了检验结果.
解答 解:A.该实验中催化剂和温度两个条件不同,无法图验证FeCl3对H2O2分解反应有催化作用,故A错误;
B.该装置中缺少搅拌仪器环形玻璃搅拌棒,无法达到实验目的,故B错误;
C.Cu与浓硝酸能够反应,而Fe与浓硝酸在常温下发生钝化现象,该装置中铜为负极,能够达到实验目的,故C正确;
D.浓盐酸具有挥发性,生成的二氧化碳中含有HCl,干扰了实验,无法达到实验目的,故D错误;
故选C.
点评 本题考查实验方案的评价,题目难度中等,涉及化学反应的影响因素、中和热测定、酸性强弱比较、原电池原理等知识,明确常见化学实验基本操作方法为解答关键,试题有利于提高学生的分析能力及化学实验能力.


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 二氧化硅是将太阳能转变为电能的常用材料 | |
| C. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| D. | 酒精能使蛋白质变性,可用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题:
有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
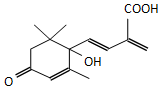 鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法不正确的是( )
鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法不正确的是( )| A. | 其分子式为C14H20O4 | |
| B. | 该物质中含有3种含氧官能团 | |
| C. | 既能发生加成反应,又能发生取代反应 | |
| D. | 既能使紫色石蕊试剂显红色,又能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=10的CH3COONa溶液中,水电离产生的c(OH-)=1×10-10mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍(溶液体积变为原来10倍)后,其pH=b,则a<b+1 | |
| C. | pH=3的H2S溶液与pH=11的NaOH溶液任意比例混合:C(Na+)+c(H+)=c(OH-)+c(HS-) | |
| D. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的:c(Na+)大小顺序为①<②<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 1000mL 0.1mol/L HCOONa溶液 |
| 乙 | 1000mL 0.1mol/L CH3COONa溶液 |
| 丙 | 1000mL含HCOONa、CH3COONa各0.05mol的溶液 |
| A. | 溶液中c(Na+):甲=乙>丙 | |
| B. | 溶液中阴、阳离子和酸分子总数:甲<丙<乙 | |
| C. | 溶液pH:甲<丙<乙 | |
| D. | 溶液中阴、阳离子总数:甲>丙>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
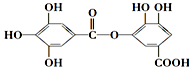
| A. | 有弱酸性,1mol该有机物与溴水反应,最多能消耗4mol Br2 | |
| B. | 在一定条件下,1mol该物质最多能与7mol NaOH完全反应 | |
| C. | 在Ni催化下,1mol该物质可以和8mol H2发生加成反应 | |
| D. | 它能发生水解反应,水解后只能生成两种产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该物质的分子式为C11H10O3 | |
| B. | 该有机物含有4种官能团 | |
| C. | 1 mol该有机物最多可以消耗2 mol NaOH | |
| D. | 该有机物不能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com