
【题目】下列说法正确的是( )
A.C4H10的一氯代物有2种
B.正戊烷分子中所有的碳原子均在同一条直线上
C.可用溴水来除去甲烷中混有的少量乙烯
D.某烃的分子式为C3H6,符合通式CnH2n,故该分子一定属于烯烃
科目:高中化学 来源: 题型:
【题目】在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)═2NO2(g),若N2O4的浓度由0.1molL﹣1降到0.07molL﹣1需要15s,那么N2O4的浓度由0.07molL﹣1降到0.05molL﹣1所需的反应时间( )
A. 等于5s B. 等于10s C. 小于10s D. 大于10s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是( )
A.CO2分子比例模型:![]()
B.硫离子的离子结构示意图:![]()
C.NH3的电子式:![]()
D.8个中子的碳原子的核素符号:12C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某研究性学习小组根据反应: 2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O。设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。
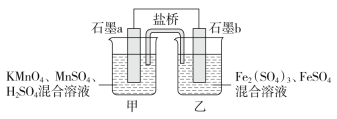
回答下列问题:
(1)此原电池的正极是石墨________(填“a”或“b”),发生________反应。
(2)电池工作时,盐桥中的SO42-移向________(填“甲”或“乙”)烧杯。
(3)两烧杯中的电极反应式分别为
甲_____________________;
乙____________________。
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为________mol。
Ⅱ.次磷酸钴(II)[Co(H2PO2)2]广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
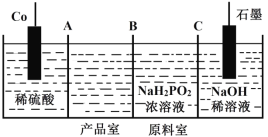
(5)A、B、C均为离子交换膜,其中为阳离子交换膜的是____________。
(6)阳极的电极反应式为________________。
(7)电解一段时间后,阴极室溶液的pH______(填“增大”“减小”或“不变”)。
(8)用Co(H2PO2)2溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成HPO32-,其离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述正确的是( )
A.气态氢化物的稳定性:CH4SiH4
B.氢元素与另一种元素形成的化合物一定是共价化合物
C.如图所示实验证明元素的非金属性:C>Si
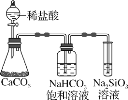
D.用中文“![]() ”命名的第118号元素在周期表中位于第七周期VIII族
”命名的第118号元素在周期表中位于第七周期VIII族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是( )
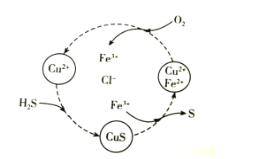
A.在图示的转化中,Fe3+和CuS是中间产物
B.在图示的转化中,化合价不变的元素只有铜
C.图示转化的总反应是2H2S+O2![]() 2S↓+2H2O
2S↓+2H2O
D.当有1molH2S转化为硫单质时,需要消耗O2的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,回答下列问题:
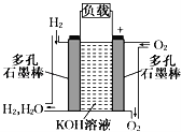
(1)O2进入的电极为___极。
(2)电池工作时:溶液中的OH-向___(填“正极”或“负极”)迁移,通__(填“H2”或“O2”)一极的电势较低。
(3)写出电池工作时的负极反应式:___。
(4)若电池工作时转移0.01mol电子,理论上消耗标准状态下__mLO2。
(5)若将此燃料电池改成以CH4和O2为原料进行工作时,负极反应式为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A.16.2g淀粉在催化剂作用下完全水解得到产物的分子数为0.1NA
B.28g乙烯与26g苯中所含的碳碳双键数均为NA
C.1molNa与足量乙醇完全反应,断裂H-O键数目为2NA
D.在密闭容器中,1molO2与2molSO2在适当催化剂作用下充分反应得到生成物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是
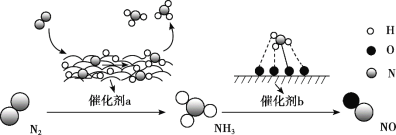
A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com