
(16分)已知:乙二酸(HOOC-COOH,可简写为H2C2O4),俗称草酸,157℃时开始分解。
(1)探究草酸的酸性
25℃ H2C2O4 K1 = 5.4×10-2,K2 = 5.4×10-5 ;H2CO3 K1=4.5×10-7 K2= 4.7×10-11
下列化学方程式可能正确的是 。
A.H2C2O4 + CO32- = HCO3- + HC2O4-
B.HC2O4- + CO32- = HCO3- + C2O42-
C.2C2O42- + CO2 + H2O = 2HC2O4- + CO32-
D.H2C2O4 + CO32- = C2O42- + H2O +CO2↑
(2)探究草酸分解产物

实验中观察到B中CuSO4粉末变蓝,C中澄清石灰水变浑浊,D的作用是 ,证明有CO气体生成的现象是 。
(3)探究催化剂对化学反应速率的影响
在甲、乙两支试管中各加入4mL 0.01mol/L KMnO4酸性溶液2mL 0.1mol/L H2C2O4溶液, 再向乙试管中加入一粒黄豆大的MnSO4固体,摇匀。填写下表:
反应现象 | |
实验结论 | |
试管中发生反应的离子方程式 |
(4)用酸性KMnO4溶液滴定Na2C2O4,求算Na2C2O4的纯度
实验步骤:准确称取2.0g Na2C2O4固体,配成100mL溶液;取出20.00mL于锥形瓶中,再向瓶中加入足量稀H2SO4;用0.0160mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
① 高锰酸钾溶液应装在_______滴定管中。(填“酸式”或“碱式”)
② Na2C2O4的纯度是______________。
(16分)(1)BD (2)吸收CO2气体;F中黑色CuO变成光亮的红色,G中澄清石灰水变浑浊。
(3)两支试管中紫色KMnO4溶液均褪色,乙试管中溶液褪色较快;MnSO4(Mn2+)是此反应的催化剂,加入催化剂可以使化学反应速率加快;2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O
(4)①酸式 ②33.5%
【解析】
试题分析:(1)电离常数越大酸性越强,则根据电离平衡常数可知酸性是H2C2O4>HC2O4—>H2CO3>HCO3—,根据较强酸制备较弱酸可知A.草酸氢根能与碳酸根反应,则反应H2C2O4 + CO32- = HCO3- + HC2O4-不正确,A错误;B.根据以上分析可知HC2O4- + CO32-=HCO3- + C2O42-是正确的,B正确;C.碳酸不能制备草酸或草酸氢根,即2C2O42- + CO2 + H2O = 2HC2O4- + CO32-是错误的,C不正确;D.草酸的酸性强于碳酸,则反应H2C2O4 + CO32- = C2O42- + H2O +CO2↑是正确的,D则,答案选BD。
(2)实验中观察到B中CuSO4粉末变蓝,说明有水蒸气产生。C中澄清石灰水变浑浊,说明有CO2产生。如果有CO,则CO还原氧化铜后生成CO2,可以使澄清石灰水变浑浊,所以必需除去CO中混有的CO2,则D的作用是吸收CO2气体;根据以上分析可知证明有CO气体生成的现象是F中黑色CuO变成光亮的红色,G中澄清石灰水变浑浊。
(3)由于催化剂能加快反应速率,则两支试管中紫色KMnO4溶液均褪色,若乙试管中溶液褪色较快,这说明在反应中MnSO4(Mn2+)是此反应的催化剂,加入催化剂可以使化学反应速率加快,反应的离子方程式为2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O。
(4)①高锰酸钾溶液具有强氧化性,能腐蚀橡胶,则应装在酸式滴定管中。
②消耗高锰酸钾的物质的量是0.025L×0.0160mol/L =0.0004mol,则根据方程式可知草酸的物质的量是0.0004mol ×5/2=0.001mol,所以根据原子守恒可知100ml溶液中草酸钠的物质的量是0.001mol×100/20=0.005mol,质量是0.005mol×134g/mol=0.67gg,因此纯度是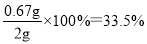 。
。
考点:考查电离常数应用、物质的检验、外界条件对反应速率的影响以及纯度沉淀与计算等


科目:高中化学 来源:2014-2015湖北省师大一附高一上学期期中化学试卷(解析版) 题型:选择题
下列各组溶液不加任何试剂,只需要用试管和滴管两两互滴就能鉴别的是
A.盐酸、氢氧化钠、氯化钠 B.氢氧化钠、氢氧化钡、硫酸
C.硫酸氢钠、碳酸钠、氢氧化钠 D.硫酸铜、盐酸、硫酸
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高一上学期期末考试化学试卷(解析版) 题型:选择题
以下物质间的转化通过一步反应不能实现的是
①.HCl →Cl2→HClO→NaClO ②.Na→Na2O2→Na2CO3→NaHCO3
③.Al→NaAlO2 →Al(OH)3→Al2O3 ④.Si→SiO2→H2SiO3→Na2SiO3
⑤.S→SO3→H2SO4→Na2SO4 ⑥.Cu →CuCl2→Cu(OH)2
A.②③ B.④⑤ C.③④⑤⑥ D.①④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第四次月考理综化学试卷(解析版) 题型:填空题
(选考)【化学——选修2:化学与技术】(15分))
(1)粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO2-4等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(2)工业生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(3)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦碳在高温的氮气流中,通过以下反应制得: SiO2 + C + N2 = Si3N4 + CO)
①配平上述反应的化学方程式__________
②该反应的平衡常数表达式为K=__________
(4)水是一种重要的自然资源,天然水在净化处理过程中加入的混凝剂可以是 __ (填两种物质名称),其净水作用的原理是__________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第四次月考理综化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.亚硫酸钠溶液加入稀硝酸:SO32-+2H+= SO2↑+H2O
B.碘水中通入足量的SO2:I2 +SO2+2H2O=2I-+SO42-+4H+
C.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省岳阳市高三教学质量检测化学试卷(解析版) 题型:选择题
在化工生产中,常用MnS(s)作沉淀剂处理含Cu2+的废水。其反应原理为:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是
CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是
A.该反应达到平衡时:c(Cu2+)=c(Mn2+)
B.CuS的溶解度比MnS的溶解度小
C.往平衡体系中加入少量Cu(NO3)2(s)后,c( Mn2 +)变大
D.该反应平衡常数表达式:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省岳阳市高三教学质量检测化学试卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数的数值,下列说法中正确的是
A.1.8 g重水(D2O)中含有的质子数和电子数均为NA
B.常温下,16gO2和O3的混合气体中含有的氧原子数为NA
C.标准状况下,22.4 L NO 和22.4 L O2 混合后所得气体中分子总数为1.5 NA
D.将11.2 L Cl2 通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期12月联考化学试卷(解析版) 题型:选择题
液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是

A.b极发生氧化反应
B.a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C.放电时,电流从a极经过负载流向b极
D.其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三一轮复习基础知识检测化学试卷(解析版) 题型:选择题
金刚烷(C10H16)的结构如图1所示,它可以看成四个等同的六元环组成的空间构型。立方烷(C8H8)的结构如图2所示。其中金刚烷的二氯代物和立方烷的六氯代物的同分异构体分别是

A.4种和1种 B.5种和3种
C.6种和3种 D.6种和4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com