
【题目】由铜、铁和硫酸铜溶液组成的原电池中,作正极的是_______________(填化学式),正极的电极反应式为____________________________;作负极的是____________________(填化学式),电子由___________________(填“正”或“负”,下同)极经导线移向________________极,总反应的离子方程式为_________________________。若以反应![]() 来设计原电池,则电池的负极材料是____________________________(填化学式,下同),电解质溶液为________________________溶液。
来设计原电池,则电池的负极材料是____________________________(填化学式,下同),电解质溶液为________________________溶液。
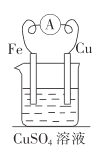
【答案】Cu Cu2++2e-=Cu Fe 负极 正极 Fe+Cu2+=Fe2++Cu Fe FeCl3
【解析】
Fe可以和CuSO4溶液发生反应,反应方程式为Fe+CuSO4=FeSO4+Cu,故可以构成原电池反应,其中Fe失去电子,作电池负极;若利用2Fe3++Fe=3Fe2+作为原电池反应,反应中Fe失去电子,做负极,Fe3+得到电子,据此分析。
根据分析,Cu电极为正极,电极方程式为Cu2++2e-=Cu;Fe做负极,电极方程式为Fe-2e-=Fe2+,电子从Fe电极流向Cu,即从负极流向正极,总反应的离子方程式为Fe+Cu2+=Fe2++Cu;根据电池方程式,Fe失去电子,故负极材料为Fe,溶液中Fe3+得电子,故电解质溶液为FeCl3。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述不正确的是

A. 该装置中电子的流动方向为:铜电极→锌电极
B. 电池工作一段时间后,甲池溶液的总质量不变
C. 电池工作一段时间后,乙池的c(SO42-)不变
D. 溶液中阳离子通过交换膜从负极区向正极区移动保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在温度不变时,水溶液中c(H+)和c(OH-)不能同时增大
B. pH=14的溶液是碱性最强的溶液
C. 中性溶液中必然有c(H+)=c(OH-)=1×10-7mol/L
D. 酸或碱溶液稀释时,溶液的pH均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关NaHCO3和Na2CO3的性质,以下叙述错误的是
A.等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积小
B.等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍
C.等质量NaHCO3和Na2CO3与盐酸完全反应,前者消耗盐酸较多
D.等物质的量的NaHCO3和Na2CO3与足量盐酸反应产生CO2一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、R在元素周期表中的相对位置如图所示,其中R元素的常见单质为气体,下列判断不正确的是( )
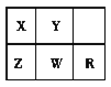
A.原子半径:Z>X> Y
B.非金属性:R>W> Z
C.X、Z对应的含氧酸均为强酸
D.Y的最简单氢化物的沸点比X的高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是( )
A. 含20.0gNaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ·mol-1
B. 已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
C. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则H2的燃烧热为241.8kJ·mol-1
D. 已知石墨转化为金刚石为吸热,那么石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( )
2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( )
A. υ(A)=0.2mol/(L·min) B. υ(B)=0.9mol/(L·min)
C. υ(C)=0.5mol/(L·min) D. υ(D)=0.4mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3===7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是()

A. 电流从左侧电极经过负载后流向右侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-===N2+6H+
D. 当有4.48 L NO2被处理时,转移电子数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的数据是( )
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的数据是( )
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1B.SO2为0.25 mol·L-1
C.SO2、SO3均为0.15 mol·L-1D.SO3为0.4 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com