
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( ) 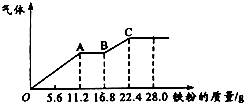
A.混合酸中H2SO4浓度为4 molL﹣1
B.200mL混合酸中NO3﹣物质的量为0.2mol
C.AB段的反应为Fe+2Fe3+═3Fe2+ , BC段产生氢气
D.加入铜粉的那份混合酸,反应后剩余0.1mol H2SO4
【答案】B
【解析】解:A.第二份反应消耗22.4g铁,物质的量为: ![]() =0.4mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.4mol,所原混合酸中H2SO4物质的量为0.4 mol×2=0.8mol,原混合溶液中硫酸浓度为:
=0.4mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.4mol,所原混合酸中H2SO4物质的量为0.4 mol×2=0.8mol,原混合溶液中硫酸浓度为: ![]() =4mol/L,故A正确;
=4mol/L,故A正确;
B.OA段发生反应为:Fe+NO3﹣+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,故原混合液中n(NO3﹣)=2n(Fe)=2× ![]() =0.4mol,故B错误;
=0.4mol,故B错误;
C.由图象可知,由于铁过量,OA段发生反应为:Fe+NO3﹣+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+ , BC段发生反应为:Fe+2H+=Fe2++H2↑,故C正确;
D.最多能溶解19.2g铜的物质的量= ![]() =0.3mol,3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O可知消耗氢离子物质的量为0.8mol,消耗NO3﹣物质的量0.2mol,依据A和B计算可知每份中硝酸物质的量0.2mol全部反应,H2SO4物质的量=4mol/L×0.1L=0.4mol,反应过程是铁先与硝酸反应,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应,铁单质全部转化为亚铁离子,硝酸全部起氧化剂作用,没有显酸性的硝酸,由反应3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O计算得到,剩余氢离子物质的量为0.2mol,依据氢离子守恒可得到,剩余H2SO4物质的量0.1mol,故D正确;
=0.3mol,3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O可知消耗氢离子物质的量为0.8mol,消耗NO3﹣物质的量0.2mol,依据A和B计算可知每份中硝酸物质的量0.2mol全部反应,H2SO4物质的量=4mol/L×0.1L=0.4mol,反应过程是铁先与硝酸反应,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应,铁单质全部转化为亚铁离子,硝酸全部起氧化剂作用,没有显酸性的硝酸,由反应3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O计算得到,剩余氢离子物质的量为0.2mol,依据氢离子守恒可得到,剩余H2SO4物质的量0.1mol,故D正确;
故选B.
由图象可知,由于铁过量,OA段发生反应为:Fe+NO3﹣+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+ , BC段发生反应为:Fe+2H+=Fe2++H2↑,
A.根据铁和硫酸的反应中铁的质量来确定所需硫酸的量,进而确定硫酸的浓度;
B.铁先与硝酸反应生成一氧化氮与铁离子,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应;
C.OA段发生反应为:Fe+NO3﹣+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,根据铁的物质的量结合离子方程式计算;
D.铁先与硝酸反应,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应,铁单质全部转化为亚铁离子,硝酸全部起氧化剂作用,没有显酸性的硝酸,依据3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O计算;


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】某非金属单质 A 和氧气发生化合反应生成B,B为气体,其体积是反应掉氧气体积的两倍(同温同压)。关于B 分子组成的推测一定正确的是( )
A. 有 2个氧原子 B. 有1个氧原子 C. 有1个A原子 D. 有2个A原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体混合物,可能含有阴离子:NO ![]() 、SO42﹣、SO32﹣、CO32﹣、AlO
、SO42﹣、SO32﹣、CO32﹣、AlO ![]() ,阳离子:K+、Al3+、Cu2+、NH
,阳离子:K+、Al3+、Cu2+、NH ![]() 、Na+ . 为了鉴定其中的离子,现进行如下实验,实验现象和结论相符的是( )
、Na+ . 为了鉴定其中的离子,现进行如下实验,实验现象和结论相符的是( )
A.向溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,说明一定含有SO ![]()
B.向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有气体逸出,说明一定存在CO32﹣和AlO ![]()
C.用焰色反应检验时,透过蓝色钴玻璃观察火焰呈紫色,则说明含有K+没有Na+
D.取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12,说明不存在NH ![]() 、Al3+、Cu2+
、Al3+、Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置可用于收集气体X并验证其某些化学性质,你认为不正确的是( ) 
选项 | 气体 | 试剂 | 现象 | 结论 |
① | SO2 | 酸性高锰酸钾溶液 | 溶液褪色 | SO2有漂白性 |
② | NH3 | 滴有紫色石蕊的盐酸 | 溶液变蓝 | 氨水显碱性 |
③ | CO2 | 氯化钡溶液 | 溶液变浑浊 | 碳酸钡难溶于水 |
④ | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
A.③④
B.②④
C.①②
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃
B.分子组成符合CnH2n+2的烃一定是烷烃
C.正戊烷分子中所有原子均在一条直线上
D.碳氢原子个数比为1:3的烃有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期常见元素形成的物质A、B、C、D、E、F的转化关系如图1所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同,也可能不同).请回答下列问题: 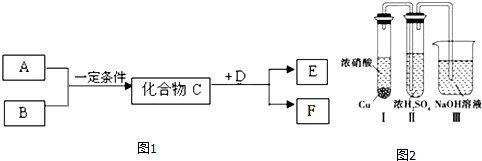
(1)若C是一种淡黄色离子化合物,B、E为同种气体,F是一种水溶液显碱性的正盐,写出C与D反应的化学方程式
(2)若A、B反应生成C是人工工业固氮的反应原理,D是双原子分子气态单质,其密度为3.17g/L(标准标况下),F在常温下是一种无色晶体,且受热易分解,写出实验室检验无机盐F中阳离子的方法: .
(3)若C是一种气体,D在常温下是一种无色无味的液体,E为无色气体,F是一种强酸.
①C与D反应的化学方程式 .
②有人认为“浓H2SO4可以干燥气体C”.甲同学为了验证该观点是否正确,用图2装置进行实验.实验过程中,在小铜块和浓硝酸刚开始反应的一段时间内浓H2SO4中未发现有气体逸出,且浓硫酸颜色加深,则你得出的结论是 .
③甲同学设计的实验中,装置Ⅲ的主要作用 .
④甲同学在实验过程中装置Ⅲ内发生一氧化还原反应生成两种钠盐,其中一种是外观与食盐很相似的有毒物质亚硝酸盐,写出该反应的方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到的气体其物质的量为a mol,向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1(在相同条件下),则a可能为( )
A.0.80
B.0.70
C.0.60
D.0.40
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应C(s)+H2O(g)CO(g)+H2(g);△H>0,下列有关说法正确的是( )
A.升高体系温度,平衡常数K减小
B.增大体系压强,平衡常数K不发生变化
C.平衡常数表达式为K= ![]()
D.增加C(s)的量,平衡正向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com