
【题目】电池式氧传感器原理构造如图,可测定O2的含量。工作时铅极表面会逐渐附着Pb(OH)2。下列说法不正确的是( )
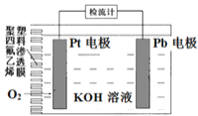
A. Pt电极上发生还原反应
B. 随着使用,电解液的碱性逐渐减弱
C. a ×10-3molO2反应,理论上可使Pb电极增重68a mg
D. Pb电极上的反应式为Pb+2OH--2e-=Pb(OH)2
【答案】B
【解析】
A.Pt电极上O2得电子生成OH-,发生还原反应,A正确;
B.铅失电子在负极发生氧化反应生成Pb(OH)2,电极反应式为Pb+2OH--2e-= Pb(OH)2,O2在正极Pt上得电子生成OH-,电极反应式为O2+2H2O+4e-=4OH-,总反应为:2Pb+O2+2H2O=2Pb(OH)2,消耗水,电解液碱性增强,所以电解液的pH逐渐增大,B错误;
C.a mmolO2反应则得到4a mmol电子,所以根据得失电子守恒,理论上可使Pb电极增重4a mmol×17g/mol=68a mg,C正确;
D.铅失电子在负极发生氧化反应生成Pb(OH)2,电极反应式为Pb+2OH--2e-=Pb(OH)2,D正确;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为______________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是_________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A. v(B)=0.3 mol·L-1· s-1B. v(A)=0.5mol·L-1· s-1
C. v(C)=0.8 mol·L-1· s-1D. v(D)=30 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.有下列各组物质:
A.O2和O3 B.![]() 和
和![]()
C.![]() 和
和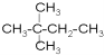
D.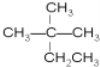 和
和 E.丁烷和新戊烷
E.丁烷和新戊烷
F.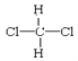 和
和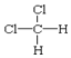 G.甲烷和庚烷
G.甲烷和庚烷
其中属于同分异构体的是____;属于同系物的是____;属于同种物质的是_____;属于同位素的是_______;属于同素异形体的是______。
Ⅱ.根据所学的有机化学反应类型,将下列反应进行归类,并按要求写出部分反应。
①由乙烯和HCl制氯乙烷 ②乙烷在空气中燃烧
③乙烯使溴水褪色 ④乙烯通入酸性高锰酸钾溶液
⑤乙烷与氯气光照 ⑥苯与硝酸在浓硫酸作用的条件下的反应
⑦苯与H2在镍作催化剂加热条件下的反应
⑧乙醇在铜作催化剂加热条件下与氧气的反应
(1)其中属于取代反应的有_____;属于氧化反应的有______;属于加成反应的有______。
(2)分别写出③⑥⑦的化学反应方程式:
③__________________
⑥__________________
⑦__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料。具体合成路线如图所示 ( 部分反应条件略去 ):
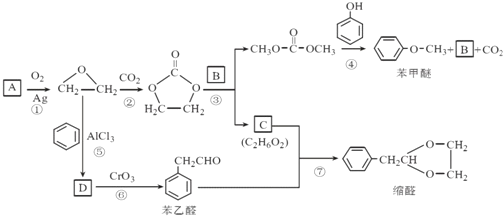
已知:①![]()
②D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子,D中氧元素的质量分数约为13.1%.
回答下列问题:
(1)A的名称是 ___ ,图中缩醛的分子式是 ___.
(2)B的结构简式为 ___.
(3)⑤的化学方程式为 ___.
(4)⑥的反应类型是 ___.
(5)请写出核磁共振氢谱有 4 组峰 , 峰面积之比为 3:2:2:1, 并含有苯环和![]() 结构的苯乙醛的所有同分异构体的结构简式: ___.
结构的苯乙醛的所有同分异构体的结构简式: ___.
(6)参照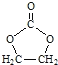 的合成路线,设计一条由2氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2氯丙烷和必要的无机试剂制备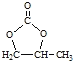 的合成路线(注明必要的反应条件 )___。
的合成路线(注明必要的反应条件 )___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入0.1 molCH3COONa固体,溶液中![]() __________________(填“增大”、“减小”或“不变”)。
__________________(填“增大”、“减小”或“不变”)。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值___________20.00(填“>”、“<”或“=”),而溶液中 c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为_____________________________。
②如果V=40.00,则此时溶液中c(OH-) -c(H+) - c(CH3COOH)= _________mol·L-1。
(3)常温下,向20 ml 0.1mol·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下图,回答下列问题:

①若将Na2CO3和NaHCO3混合物配成溶液,则此溶液的pH的取值范围是________________;
为测定Na2CO3和NaHCO3混合物中的质量分数,下列方案可行的是_________________
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
②所得溶液中含量最多的三种离子的物质的量浓度的大小关系为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(忽略溶液体积的变化),溶液中部分微粒的物质的量浓度不正确的是 ( )
A. 向0.20 mol/L NH4HCO3中通入CO2: C(NH4+)=C(HCO3-)+2C(CO32-)
B. 向0.15 mol/L NaHSO3中通入NH3: C(Na+)>C(NH4+)>C(SO32-)
C. 向0.30mol/L Na2SO3中通入CO2: C(Na+)=2[C(SO32-)+C(HSO3-)+C(H2SO3)]
D. 向0.10 mol/L CH3COONa中通入HCl:C(Na+)>C(CH3COOH)=C(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子可以在指定溶液中大量共存的是( )
A.强酸性溶液中:Mg2+、SO42-、Na+B.久置氯水中:K+、CO32-、Ag+
C.无色溶液中:SO42-、MnO4-、Fe3+D.强碱性溶液中:OH-、Cu2+、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com