
| A、CH3COOH |
| B、H2SO4 |
| C、NH4Cl |
| D、NaOH |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、经常饮用咖啡、碳酸饮料 |
| B、经常饮用钙离子含量高的硬水 |
| C、经常饮用牛奶、豆奶 |
| D、大量补充维生素C |
查看答案和解析>>
科目:高中化学 来源: 题型:
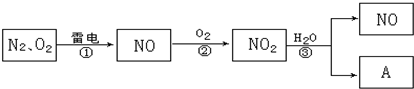
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液中:Na+、K+、MnO4-、C2O42- |
| B、0.1mol/LFeCl3溶液中:Mg2+、NH4+、SCN-、SO42- |
| C、0.1mol/LNH4HCO3溶液中:K+、Na+、NO3-、Cl- |
| D、水电离出来的c(H+)=1×10-13mol/L的溶液中:Fe2+、Cu2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
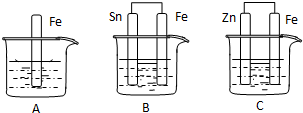 如图所示,烧杯中都盛有稀硫酸.
如图所示,烧杯中都盛有稀硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
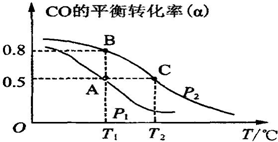
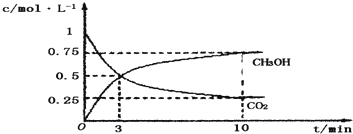
| 16 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2SO2+O2
| ||||
| B、SO2+2H2S═3S↓+2H2O | ||||
| C、SO2+NaOH═NaHSO3 | ||||
| D、SO2+Cl2+H2O═H2SO4+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中c(SO42-)为0.1mol/L、c(CO32-) 为0.2mol/L |
| B、该混合物中不含Ba2+、Mg2+ |
| C、一定存在NH4+、K+,无法确定Cl-是否存在 |
| D、实验(3)沉淀中加盐酸后,若只过滤、不洗涤,会对除NH4+外的其他离子含量的测定造成影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com