
【题目】下图是某儿童微量元素体检报告单的部分数据:
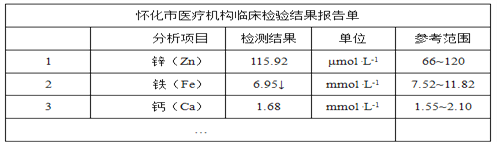
根据上表的数据,回答下列问题:
(1)该儿童__元素含量偏低。
(2)报告单中“μmol·L-1”是__(填“质量” “体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C表现出__________(填“氧化性”或“还原性”)。
(4)硫酸亚铁晶体(FeSO47H2O)在医疗上可作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如图:
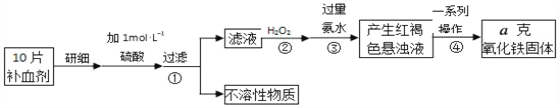
请回答下列问题:
a.②中H2O2的作用是__。
b.④中一系列处理的操作步骤为过滤、______、灼烧、冷却、称量。
c. 下列操作会导致所测定的铁元素含量偏高的是__。
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分
d. 写出步骤③中发生的离子方程式_____________________________________
e、简述滤液中存在Fe3+的检验方法是:_______________________________________
【答案】 铁(或Fe) 浓度 还原性 将Fe2+全部氧化为Fe3+ 洗涤 BC Fe3++3NH3·H2O =Fe(OH)3↓+3NH4+ 取少许滤液于试管中,滴几滴硫氰化钾溶液,溶液迅速出现血红色,证明存在铁离子
【解析】(1)根据体检报告单,铁(或Fe)元素含量偏低,故答案为:铁(或Fe);
(2)报告单中μmol/L是浓度的单位,故答案为:浓度;
(3)服用维生素C可使食物中的Fe3+转化为Fe2+,Fe元素的化合价降低被还原,则则维生素C所起还原作用,故答案为:还原性;
(4)由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量。
a.双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,故答案为:将Fe2+全部氧化为Fe3+;
b步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,故答案为:洗涤;
c.A、步骤③所加氨水量不足,铁离子沉淀不完全,生成的氢氧化铁减少,氧化铁质量减少,测定结果偏低,故A错误;B、步骤④洗涤不充分,会导致氧化铁的质量偏大,测得的铁元素质量分数偏大,故B正确;C、步骤④灼烧不充分,会导致氧化铁固体的质量偏大,铁元素质量分数偏大,故C正确;故选BC;
d. 写出步骤③中铁离子与氨水反应生成氢氧化铁沉淀,反应的离子方程式为Fe3++3NH3·H2O =Fe(OH)3↓+3NH4+,故答案为:Fe3++3NH3·H2O =Fe(OH)3↓+3NH4+;
e、检验Fe3+可以利用硫氰化钾溶液,方法是取少许滤液于试管中,滴几滴硫氰化钾溶液,溶液迅速出现血红色,证明存在铁离子,故答案为:取少许滤液于试管中,滴几滴硫氰化钾溶液,溶液迅速出现血红色,证明存在铁离子。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】碳酸钙、盐酸是中学化学实验中的常用试剂.
(1)甲同学拟测定CaCO3固体与过量0.1molL﹣1 HCl的反应速率.
①该反应的离子方程式为 .
②设计实验方案:通过测量计算反应速率
(2)乙同学拟用如图装置探究固体表面积和反应物浓度对化学反应速率的影响.电子天平限选试剂与用品:0.1molL﹣1 HCl、颗粒状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
(i)设计实验方案:在反应物浓度或固体表面积不同的条件下,测定
(要求所测得的数据能直接体现反应速率大小).
(ⅱ) 根据(i)中设计的实验测定方案,拟定实验表格,完整体现实验方案.列出所用试剂的用量、待测物理量;数据用字母a、b、c、d表示.
已知实验1和2探究固体表面积对反应速率的影响;
实验1和3探究反应物浓度对反应速率的影响.
写出表中①﹣⑥所代表的必要数据或物理量
物理量 | V(0.1molL﹣1 HCl)/mL | m(颗粒状CaCO3)/g | m(粉末状CaCO3)/g | V(蒸馏水)/mL | ⑤ | ⑥ |
实验1 | a | b | 0 | c | d | |
实验2 | 0 | c | d | |||
实验3 | c | 0 | d |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A.ClO2﹣的空间构型为平面三角形
B.SiF4和SO32﹣的中心原子均为sp3杂化
C.在所有的元素中,氟的第一电离能最大
D.C2H5OH分子中共含有8个极性键,1个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(氧氮杂 ![]() 是新药研制过程中发现的一类重要活性物质,具有抗惊厥、抗肿瘤、改善脑缺血等性质.下面是某研究小组提出的一种氧氮杂
是新药研制过程中发现的一类重要活性物质,具有抗惊厥、抗肿瘤、改善脑缺血等性质.下面是某研究小组提出的一种氧氮杂 ![]() 类化合物H的合成路线:
类化合物H的合成路线: 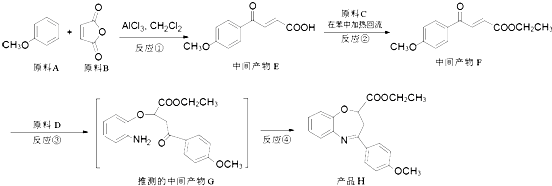
(1)原料A的同分异构体中,含有苯环、且核磁共振氢谱中有4个峰的是(写出其结构简式).
(2)反应②的化学方程式是 .
(3)③的反应类型是 . 原料D中含有的官能团名称是、 .
(4)原料B俗名“马莱酐”,它是马莱酸(顺丁烯二酸: ![]() )的酸酐,它可以经下列变化分别得到苹果酸(
)的酸酐,它可以经下列变化分别得到苹果酸( ![]() )和聚合物Q:
)和聚合物Q: 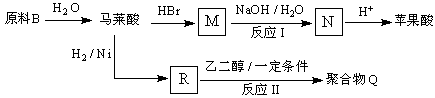
写出反应Ⅰ和反应Ⅱ的化学方程式:、 .
(5)符合下列条件的中间产物F的同分异构体数目是(不考虑手性异构),写出其中任意一种的结构简式 . (i)能发生银镜反应;
(ii)分子中含有三取代的苯环结构,其中两个取代基是:﹣COOCH3和 ![]() ,且二者处于对位.
,且二者处于对位.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2,(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2B.Ag2O+H2O2===2Ag+O2+H2O
C.2H2O2===2H2O+O2D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是__(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是__(填代号)。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO4﹣+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________。
(4)在K2Cr2O7+14HCl===2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3 mol电子转移时生成Cl2的体积为:_______标准状况),被氧化的HCl的物质的量为__。
(5)除去镁粉中混入的铝粉杂质用溶解、_______方法,化学反应方程式为_________。
(6)下列物质中:①NaNO3固体、②熔融KCl、③液氨、④石墨、⑤氯化氢、⑥盐酸、⑦蔗糖。其中:
属于电解质的是:__(填序号,下同);
既不是电解质也不是非电解质的是:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列两套装置的描述不正确的是( ) 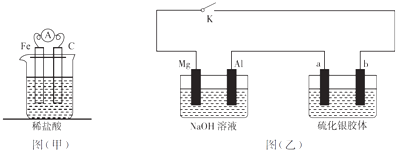
A.甲装置为铁的析氢腐蚀,若将铁换成铜,则甲装置就是铜的吸氧腐蚀
B.若将甲装置中的电流表改为电源,无论电源怎么连接,C电极上都会有气体放出
C.乙装置中K关闭后,a极附近颜色逐渐加深变黑
D.若将乙装置中的NaOH溶液换为HCl溶液,则K关闭后b极颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在.
(1)下列关于CaF2的表述正确的是 .
a.Ca2+与F﹣间仅存在静电吸引作用
b.F﹣的离子半径小于Cl﹣ , 则CaF2的熔点高于CaCl2
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是(用离子方程式表示).
已知AlF63﹣在溶液中可稳定存在.
(3)F2通入稀NaOH溶液中可生成OF2 , OF2分子构型为 , 其中氧原子的杂化方式为
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等.已知反应Cl2(g)+3F2(g)═2ClF3(g)△H=﹣313kJmol﹣1 , F﹣F键的键能为159kJmol﹣1 , Cl﹣Cl键的键能为242kJmol﹣1 , 则ClF3中Cl﹣F键的平均键能为kJmol﹣1 . ClF3的熔、沸点比BrF3的(填“高”或“低”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器:①烧杯;②锥形瓶;③圆底烧瓶;④试管;⑤坩埚;其中可以用酒精灯直接加热的仪器是( )
A. ①②③④ B. ④⑤ C. ①③ D. ④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com