
反应:N2(g)+3H2(g)⇌2NH3(g)△H<0.在等容条件下进行.体系中各物质浓度随时间变化的曲线如图1所示,回答问题:
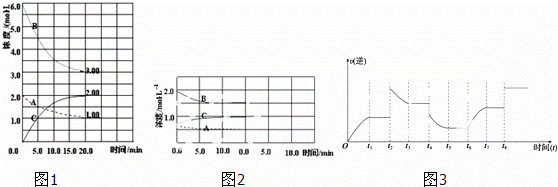
(1)图1中B为 (填“N2”、“H2”或“NH3”)计算反应从开始→达平衡时H2的反应速率v(H2)=
(2)图1是在某温度下反应达到平衡,将容器的体积扩大一倍,假定10min后达到新的平衡,请在图2中用曲线表示体系中各物质的浓度随时间变化的趋势(不需计算新平衡时的具体浓度,只要新平衡时浓度处于一个合理范围内即可.曲线上必须标出N2、H2、NH3).
(3)若该反应的逆反应速率与时间的关系如图3所示:反应在t1、t3、t5、t7时都达到了平衡,而t2、t4、
t6、t8时都改变了条件,试判断改变的条件是(填“升温”、“降压”…等);t2时 ;t6时 ;t4时,平衡向 (填“正”或“逆”)反应方向移动.
考点:
物质的量或浓度随时间的变化曲线;化学平衡的影响因素.
专题:
化学平衡专题.
分析:
(1)根据反应的化学计量数可知,变化量最大的是氢气;根据图象中的浓度变化及时间计算出用H2的浓度变化表示的化学反应平均速率;
(2)达到平衡后,将容器的体积扩大一倍,改变条件的瞬间,各组分的浓度变为原来的二分之一,容器体积增大,压强降低平衡向体积增大的方向移动,即逆向移动,但增大的物质的量浓度小于原平衡时浓度,同时注意各组分物质的量浓度变化量之比等于化学计量数之比,据此作图;
(3)该反应的反应物气体的体积小于生成物气体的体积,增大压强,平衡向正反应方向移动,正反应为放热反应,升高温度平衡向逆反应方向移动,结合逆反应速率的变化解答该题.
解答:
解:(1)据反应的化学计量数可知,变化量最大的是氢气,v(H2)= mol•L﹣1•min﹣1=0.15mol•L﹣1•min﹣1,故答案为:H2;0.15mol•L﹣1•min﹣1;
mol•L﹣1•min﹣1=0.15mol•L﹣1•min﹣1,故答案为:H2;0.15mol•L﹣1•min﹣1;
(2)达到平衡后,将容器的体积扩大一倍,改变条件的瞬间,各组分的浓度变为原来的二分之一,容器体积增大,压强降低平衡向体积增大的方向移动,即逆向移动,但增大的物质的量浓度小于原平衡时浓度,同时注意各组分物质的量浓度变化量之比等于化学计量数之比,由此可得图为: ,故答案为:
,故答案为: ;
;
(3)t2时逆反应速率增大,至t3时逐渐减小,平衡向逆反应方向移动,应是升高温度,t6时逆反应速率逐渐增大,平衡向正反应方向移动,应是增加反应物的浓度,
t4时逆反应速率减小,至t5时逐渐减小,反应向逆反应方向移动,故答案为:升温;增大N2或H2浓度; 逆.
点评:
本题综合考查化学反应速率和化学平衡的移动及影响因素,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意把握反应的特征,结合图象的曲线变化解答该题.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
反应2SO2+O2⇌2SO3,经过一段时间后,O2的浓度增加了4mol/L,在这段时间内用O2表示的反应速率为0.4mol/(L•s),则这段时间为()
A. 0.1 s B. 2.5 s C. 5 s D. 10 s
查看答案和解析>>
科目:高中化学 来源: 题型:
在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵.滤出小苏打后,母液提取氯化铵有两种方法:①通入氨,冷却、加食盐,过滤②不通氨,冷却、加食盐,过滤对上述两种方法评价中错误的是()
A. ①析出的氯化铵纯度更高 B. ①的滤液可直接循环使用
C. ②析出的氯化铵纯度不高 D. ②的滤液可直接循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,能证明某物质是强电解质或弱电解质的是( )
|
| A. | 某物质熔化时不导电,则该物质为弱电解质 |
|
| B. | 某物质不是离子化合物,而是极性共价化合物,则该物质为弱电解质 |
|
| C. | 某一元酸2 mol与足量Zn完全反应生成1 molH2,则该酸为强酸 |
|
| D. | 溶液中已电离的离子和未电离的分子共存,则该物质为弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
结合图判断,下列叙述正确的是( )
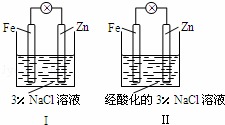
|
| A. | Ⅰ和Ⅱ中正极均被保护 |
|
| B. | Ⅰ和Ⅱ中负极反应均是:Fe﹣2e﹣═Fe2+ |
|
| C. | Ⅰ正极反应是:O2+2H2O+4e﹣═4OH﹣ |
|
| D. | Ⅰ和Ⅱ中分别加入少量KSCN溶液,溶液均变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关气体摩尔体积的描述中正确的是( )
-A.-相同条件下,气体物质的量越大,气体摩尔体积越大
-B.-通常状况下的气体摩尔体积大于22.4L/mol
-C.-非标准状况下的气体摩尔体积不可能为22.4L/mol
-D.-在标准状况下,混合气体的气体摩尔体积比22.4L/mol大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
-A.-用量筒量取20.0mL 0.500 0 mol•L﹣1 H2SO4溶液于烧杯中,加80 mL配制成0.100 0 mol•L﹣1 H2SO4溶液
-B.-选用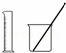 配制100 mL 0.100 0 mol•L﹣1 KMnO4溶液
配制100 mL 0.100 0 mol•L﹣1 KMnO4溶液
-C.-将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液
-D.-用1 g 98%的浓硫酸加4 g水配制成19.6%的硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:正确的操作顺序是( )
①加入稍过量的Na2CO3溶液;
②加入稍过量的NaOH溶液;
③加入稍过量的BaCl2溶液;
④滴入稀盐酸至无气泡产生;
⑤过滤.
|
| A. | ③②①⑤④ | B. | ①②③⑤④ | C. | ②③①④⑤ | D. | ③⑤②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在碘水中加入四氯化碳,充分振荡后静置,现象是( )
|
| A. | 上层液体呈现紫红色,下层液体几乎无色 |
|
| B. | 液体呈均匀紫红色 |
|
| C. | 下层液体呈现紫红色,上层液体几乎无色 |
|
| D. | 溶液呈无色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com