
【题目】某温度时,在2L恒容容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。

(1)由图中的数据分析,该反应的化学方程式为___。
(2)反应开始至2min、5min时,Z的平均反应速率分别为___、___。
(3)5min后Z的生成速率___(填“大于”“小于”或“等于”)5min末Z的生成速率。
【答案】3X+Y![]() 2Z 0.05mol·L-1·min-1 0.04mol·L-1·min-1 等于
2Z 0.05mol·L-1·min-1 0.04mol·L-1·min-1 等于
【解析】
根据达到平衡时各物质的变化量找出化学方程式的系数关系,并写出化学方程式;根据三段式进行相应计算。
(1)由图中的数据分析,5min达到平衡,Z增加0.4mol,Y减少0.2mol,X减少0.6mol,故X、Y、Z系数比为:3:1:2;该反应的化学方程式为:3X+Y![]() 2Z;
2Z;
(2)反应开始至2min时,Z增加0.2mol ,浓度变化0.1mol/L,Z的平均反应速率为:![]() =0.05mol·L-1·min-1;5min时,Z增加0.4mol,浓度变化0.2mol/L,Z的平均反应速率为:
=0.05mol·L-1·min-1;5min时,Z增加0.4mol,浓度变化0.2mol/L,Z的平均反应速率为:![]() =0.04mol·L-1·min-1;
=0.04mol·L-1·min-1;
(3)5min时,化学反应达到了平衡状态,反应达到了一定限度,各物质的反应速率不再改变,故5min后Z的生成速率与5min末Z的生成速率相等。


科目:高中化学 来源: 题型:
【题目】把VL含有![]() 和
和![]() 的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使铁离子完全沉淀为氢氧化镁;另一份加入含
的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使铁离子完全沉淀为氢氧化镁;另一份加入含![]() 溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的物质的量浓度是( )
溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的物质的量浓度是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为直流电源电解稀Na2SO4溶液的装置。通电一段时间后,在石墨电极a和b附近分别滴加一滴酚酞溶液。则下列有关说法中正确的是( )

A.a电极产生H2
B.两极产生的气体均有刺激性气味
C.通电一段时间后,稀Na2SO4溶液酸性增强
D.a电极附近呈无色,b电极附近呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地酸雨可能含有下表中的离子。取一定量该地酸雨分成A、B、C、D四份,进行如下探究:


请回答下列问题:
(1)该酸雨中肯定存在的离子有____________________________________________。
(2)不能肯定存在的阴离子是________,能证明该阴离子是否存在的简单实验操作为________________________________________________________________________。
(3)写出溶液中滴加淀粉KI溶液所发生反应的离子方程式:______________________________。
(4)为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,再喷射适量蒸馏水即得硫酸型酸雨,NO的作用为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子晶体晶胞的结构如图所示。X(●)位于立方体顶点,Y(○)位于立方体中心。试

(1)晶体中每个Y同时吸引着__个X,每个X同时吸引着__个Y,该晶体的化学式为____________。
(2)晶体中每个X周围与它最接近且距离相等的X共有___个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是____。
(4)设该晶体的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废料含SiO2、FeS和CuS等物质,采用如下实验方案进行回收利用。请回答下列问题:
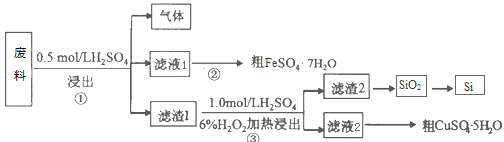
(1)已知步骤①中发生的化学反应为非氧化还原反应,写出产生气体的电子式_______,该气体可用足量的NaOH溶液吸收,该反应的离子方程式是__________________。
(2)步骤②的操作依次为______、_______、过滤、洗涤、干燥。滤渣2的主要成分是SiO2和S,写出步骤③涉及的化学方程式________________________________。
(3)所得硫酸亚铁晶体中的Fe2+,可以用_________________________(填试剂化学式)检验。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() ,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:
,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:
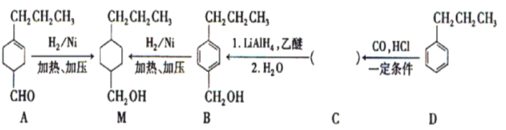
(1)常温下,下列物质能与A发生反应的有_______ (填序号)
a.乙酸 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)M中官能团的名称是___________,由C→B反应类型为________ 。
(3)由A催化加氢生成M的过程中,可能生成的中间产物除了![]() 还有________(写结构简式)。
还有________(写结构简式)。
(4)检验B中是否含有C可选用的试剂是_____________。
(5)C的一种同分异构体E具有如下特点:a.分子中含—OCH2CH3 b.苯环上只有两种化学环境不同的氢原子,写出E在一定条件下发生加聚反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g) ![]() 2C(g),达到平衡后,在不同的时间段内反应物的浓度随时间的变化如图甲所示,正逆反应速率随时间的变化如图乙所示,下列说法中正确的是( )
2C(g),达到平衡后,在不同的时间段内反应物的浓度随时间的变化如图甲所示,正逆反应速率随时间的变化如图乙所示,下列说法中正确的是( )
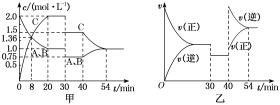
A.30~40 min间该反应使用了催化剂
B.化学方程式中的x=1,正反应为吸热反应
C.30 min时降低温度,40 min时升高温度
D.8 min前A的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com