


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3:CO32-+2H2O?H2CO3+2OH- |
| B、CuSO4:Cu2++2H2O?Cu(OH)2↓+2H+ |
| C、CH3COONa:CH3COO-+H2O?CH3COOH+OH- |
| D、NaCl:Cl-+H2O?HCl+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
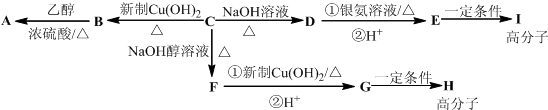
科目:高中化学 来源: 题型:
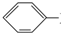
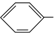
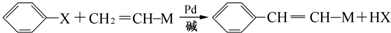
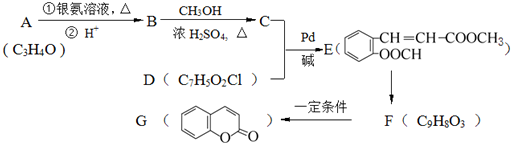
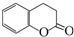 ) 常用作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体(
) 常用作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体(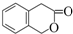 )需要用到的试剂有:NaOH溶液、
)需要用到的试剂有:NaOH溶液、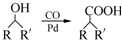 (R,R′为烃基).试写出以苯和丙烯(CH2=CH-CH3)为原料,合成
(R,R′为烃基).试写出以苯和丙烯(CH2=CH-CH3)为原料,合成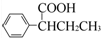 的路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2→CH3CH2Br
的路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2→CH3CH2Br| NaOH溶液 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(HA) |
| c(OH-) |
| c(H+) |
| c(H+)?c(A-) |
| c(HA) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com