
| A、饱和石灰水中加入生石灰,若保持温度不变,则溶液中Ca2+的物质的量不变 |
| B、升高饱和石灰水的温度时,Ca(OH)2溶度积常数Ksp减小 |
| C、饱和石灰水中加入生石灰,若保持温度不变,则pH不变 |
| D、向饱和石灰水中加入浓CaCl2溶液会有Ca(OH)2沉淀析出 |


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
 已知A、B、D、E四种物质均含有氧元素.D为气体单质,E为黑色粉末.A和B分别经E催化都会分解产生D.B通常为液态,由两种元素组成,原子个数比为1:1,且1molB含18mol电子.试回答下列问题.
已知A、B、D、E四种物质均含有氧元素.D为气体单质,E为黑色粉末.A和B分别经E催化都会分解产生D.B通常为液态,由两种元素组成,原子个数比为1:1,且1molB含18mol电子.试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
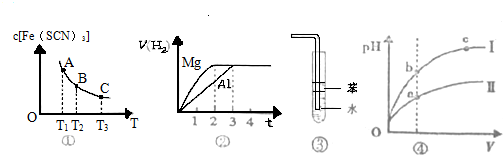
| A、已知图①是体系Fe3++3SCN-?Fe(SCB)3中c[Fe(SCN)3]与温度T的平衡图象,则A点与B点相比,A点的Fe3+浓度大 |
| B、图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V(H2) 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 |
| C、图③可用于吸收HCl气体,并防倒吸 |
| D、图④是某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线,II为醋酸稀释时pH的变化曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| t/min | CO(g)/(mol?L-1) | H2O(g)/(mol?L-1) | CO2(g)/(mol?L-1) | H2(g)/(mol?L-1) |
| 0 | 0.20 | 0.3 | 0 | 0 |
| 3 | 0.08 | 0.18 | c | c |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2++2HCO3-+Ca2++2OH-=MgCO3↓+CaCO3↓+2H2O |
| B、Cu2++H2S=Cu S↓+2H+ |
| C、Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑ |
| D、FeS+2H+=Fe2++H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质.为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5g纯碱样品放人烧杯中,将烧杯放在电子称上,再把0.0g稀盐酸(足量)加入样品中.观察读数变化如下表所示:
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质.为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5g纯碱样品放人烧杯中,将烧杯放在电子称上,再把0.0g稀盐酸(足量)加入样品中.观察读数变化如下表所示:| 时间/s | 0 | 5 | 10 | 15 |
| 读数/g | 215.2 | 211.4 | 208.6 | 208.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 |
KClO3(g) | 氧化物 | 产生气体(mL) (已折算为标况) |
耗时(s) | ||
| 化学式 | 质量(g) | 实际回收 | ||||
| 1 | 0.6 | - | - | - | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | 异常 | 67.2(有刺激性气味) | 188.3 |
| A、催化剂的催化能力Fe2O3>MnO2>CuO |
| B、实验2、3、4中KClO3分解百分率相同 |
| C、实验1设计对本实验无意义 |
| D、Cr2O3在反应中起到还原剂作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 四种基本反应类型与氧化还原反应的关系 |
B、 AlCl3溶液滴加NaOH溶液生成沉淀的情况 |
C、 Ba(OH)2溶液中滴加硫酸溶液导电性的情况 |
D、 等体积等浓度稀硫酸分别与足量铁和镁反应的情况 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com