
| A、①③⑤ | B、①④⑤ |
| C、②④ | D、全部 |


科目:高中化学 来源: 题型:
 油价的持续“高烧”,引发人们对未来能源供需及价格的深切关注,并且促使人们寻求石油的替代品.
油价的持续“高烧”,引发人们对未来能源供需及价格的深切关注,并且促使人们寻求石油的替代品.| 编号 | ① | ② | ③ |
| 装置 | 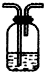 | 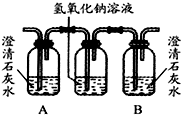 | 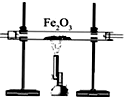 |
查看答案和解析>>
科目:高中化学 来源: 题型:
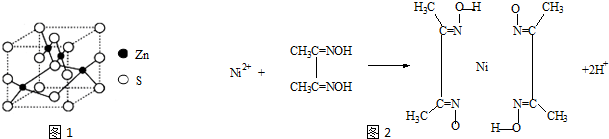
查看答案和解析>>
科目:高中化学 来源: 题型:
 溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法错误的是( )
溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法错误的是( )| A、温度升高时溴酸银溶解速度加快 |
| B、溴酸银的溶解是放热过程 |
| C、60℃时,溴酸银的Ksp约等于6×10-4 |
| D、常温下溴酸银微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性强弱:HClO>H2SO4>H2CO3 |
| B、热稳定性:HF>HCl>HBr |
| C、已知硒(Se)与硫同主族,其最高价氧化物对应的水化物分子式为:H2SeO3 |
| D、原子半径大小:Na>P>N |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在酸性环境中钢铁发生析氢腐蚀 |
| B、电解质溶液为氢氧化钠溶液,铝和镁形成原电池时,镁作负极 |
| C、铅蓄电池中铅做正极,PbO2做负极,两极浸在H2SO4溶液中 |
| D、镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.9 mol |
| B、1.2 mol |
| C、1.5 mol |
| D、1.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
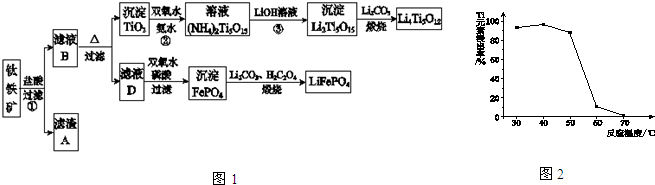
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2既是氧化产物又是还原产物 |
| B、氧化产物与还原产物物质的量之比为1:2 |
| C、联氨是氧化剂 |
| D、氧化剂与还原剂物质的量之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com