
| A. | KSCN | B. | NH3•H2O | C. | NaOH溶液 | D. | H2S溶液 |
分析 二者离子都不和酸反应,都能和碱反应,但氢氧化铝能溶于强碱溶液,氢氧化铁不溶于强碱溶液,据此分析解答.
解答 解:A.铁离子和KSCN溶液生成络合物而导致溶液呈血红色,铝离子和KSCN溶液不反应,但硫氰化铁和铝离子仍然混溶,不能分离,只能鉴别,故A错误;
B.两种离子都和一水合氨反应生成氢氧化物沉淀,所以不能分离,故B错误;
C.Fe3+和NaOH反应生成Fe(OH)3红褐色沉淀,Al3+和少量NaOH溶液反应生成氢氧化铝沉淀,和过量NaOH溶液反应生成可溶性的NaAlO2,然后采用过滤方法分离,所以可以用NaOH溶液分离Fe3+和Al3+离子,故C正确;
D.Fe3+和H2S发生氧化还原反应生成Fe2+和S,Al3+离子和H2S发生不反应,故D错误;
故选C.
点评 本题考查离子的分离,侧重考查元素化合物知识,明确离子的性质及离子性质的差异性是解本题关键,易错选项是D,注意:铁离子和氢硫酸发生氧化还原反应,氢氧化铝能溶于强碱但不能溶于弱碱,题目难度不大.


科目:高中化学 来源: 题型:选择题
 在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )
在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )| A. | P3>P4,Y轴表示混合气体的平均摩尔质量 | |
| B. | P3>P4,Y轴表示混合气体的密度 | |
| C. | P3<P4,Y轴表示A2的浓度 | |
| D. | P3<P4,Y轴表示A2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2→SiF4 | B. | Al2O3→Al(OH)3 | C. | Fe→FeCl2 | D. | SiO2→CaSiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
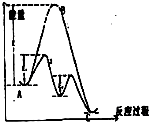
| A. | 使用正催化剂能够加快反应的速率,根本上是由于催化剂参与反应,并且同等程度地降低了正逆反应的活化能 | |
| B. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑△H>0,该反应过程可用该图象表示 | |
| C. | 使用催化剂不仅能加快反应速率,而且可以让不可能发生的反应发生,如利用催化技术处理汽车尾气:2CO+2NO═2CO2+N2 | |
| D. | 化学反应的本质是旧键断裂,新键形成,如图可知反应的能量变化由旧键断裂释放的能量和新键形成吸收的能量大小决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
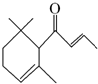 一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )| A. | 分子式为C13H20O | |
| B. | 该化合物可发生聚合反应 | |
| C. | 1 mol该化合物完全燃烧消耗19 mol O2 | |
| D. | 与足量溴水加成,最多消耗Br22 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol/L) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com