
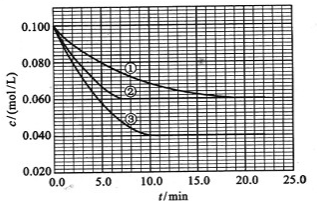
 (2013?潍坊模拟)在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.1mol/L,c(B)=0.2mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
(2013?潍坊模拟)在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.1mol/L,c(B)=0.2mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.| 0.04 |
| 0.1 |
| 0.028mol |
| 4min |


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
| O | 2- 3 |
| O | 2- 4 |
| O | 2- 4 |
| O | 2- 4 |
| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
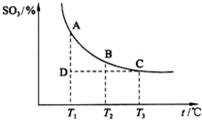 (2013?潍坊模拟)如图,研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.
(2013?潍坊模拟)如图,研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.| 3 |
| 2 |
| H | 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com