

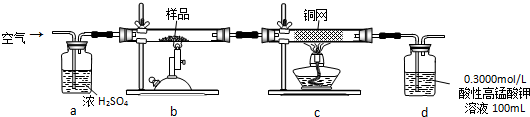
分析 本实验用浓盐酸与二氧化锰反应生成氯气,随着反应的进行,浓盐酸变稀后反应就会停止,由于氯气中有氯化氢和水杂质,所以用饱和食盐水和浓硫酸除杂,要先除氯化氢后除水,除杂后的氯气与硅反应生成四氯化硅,未反应的氯气有毒,所以用碱石灰吸收尾气,同时碱石灰还可以防止空气中的水分进入装置与四氯化硅反应,由于空气中的水分与四氯化硅会反应,所以在反应的开始用氯气将装置中的空气排尽,据此答题.
解答 解:本实验用浓盐酸与二氧化锰反应生成氯气,随着反应的进行,浓盐酸变稀后反应就会停止,由于氯气中有氯化氢和水杂质,所以用饱和食盐水和浓硫酸除杂,要先除氯化氢后除水,除杂后的氯气与硅反应生成四氯化硅,未反应的氯气有毒,所以用碱石灰吸收尾气,同时碱石灰还可以防止空气中的水分进入装置与四氯化硅反应,由于空气中的水分与四氯化硅会反应,所以在反应的开始用氯气将装置中的空气排尽,
(1)根据实验装置图可知,检验装置的气密性的方法是堵住导管出口,打开分液漏斗活塞,向分液漏斗中注入蒸馏水,过一会,如果分液漏斗中液面不再下降,则气密性良好,
故答案为:堵住导管出口,打开分液漏斗活塞,向分液漏斗中注入蒸馏水,过一会,如果分液漏斗中液面不再下降,则气密性良好;
(2)A装置中是浓盐酸与二氧化锰反应生成氯气,反应的离子方程式为MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)根据实验装置图可知,A装置中玻璃实验仪器有分液漏斗、圆底烧瓶、酒精灯,
故答案为:分液漏斗;圆底烧瓶;
(4)根据上面的分析可知,B中的液体为饱和食盐水,F中碱石灰的作用为①吸收多余氯气,②防止空气中水蒸气从末端进入D中,
故答案为:饱和食盐水;吸收多余氯气;防止空气中水蒸气从末端进入D中;
(5)由于实验中要先将装置中的空气排尽,防止硅与空气反应,所以先加热图中A装置,随着反应进行,浓盐酸会变稀,稀盐酸不和二氧化锰反应,所以若实验中用12mol•L-1浓盐酸10mL与足量的MnO2反应,生成Cl2的物质的量总是小于0.03mol,
故答案为:A;利用A所产生的氯气排尽装置中的空气等,防止硅与空气反应;随着反应进行,浓盐酸会变稀,稀盐酸不和二氧化锰反应.
点评 本题考查制备实验方案的设计,综合了氯气的制法、除杂、尾气吸收等实验知识,注意把握制备原理及实验流程中的反应、物质的性质等为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:填空题
| A.元素原子的核外p电子总数比s电子总数少1 |
| B.元素价电子排布式为nsnnp2n |
| C.元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| D.原子核外所有p轨道全满或半满 |
| E.元素的主族序数与周期数的差为4 |
| F.是前四周期中电负性最小的元素 |
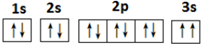
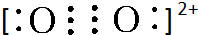 ;1mol B22+中含有的π键数目为2NA.
;1mol B22+中含有的π键数目为2NA.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 熔点 | 沸点 | |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com