
| A. | 2-戊烯的同分异构体数目为五种 | |
| B. | 丙烯与HCl加成产物是1-氯丙烷 | |
| C. | 组成为CnH2n的烃,当n=4时,才具有同分异构体 | |
| D. | 能使溴水或酸性KMnO4溶液褪色的C4H8的物质可能有三种 |
分析 A、先根据碳链异构书戊烷,再根据双键位置异构书写戊烯的同分异物体,烯烃的同分同分异构体还可能为环烷烃;
B、丙烯不是对称结构,与HCl发生加成反应,氢原子和氯原子上的位置可以不一样;
C、组成为CnH2n的烃,也可以是环烷烃;
D、能使溴水或酸性KMnO4溶液褪色的C4H8的物质为烯烃;
解答 解:A、戊烷有3种同分异构体: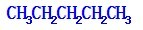 ,
, ,
, ,对应的戊烯分别为:3种,3种,0种,所以2-戊烯的同分异构体属于烯烃的同分异构体有5种,属于环烷烃的有3种:环戊烷,甲基环丁烷,1,1-二甲基环丙烷,1,2-二甲基环丙烷,则2-戊烯的同分异构体数目为8种,故A错误;
,对应的戊烯分别为:3种,3种,0种,所以2-戊烯的同分异构体属于烯烃的同分异构体有5种,属于环烷烃的有3种:环戊烷,甲基环丁烷,1,1-二甲基环丙烷,1,2-二甲基环丙烷,则2-戊烯的同分异构体数目为8种,故A错误;
B、丙烯不是对称结构,与HCl发生加成反应,可以得到1-氯丙烷和2-氯丙烷,故B错误;
C、组成为CnH2n的烃,当n=3时,可以丙烯或环丙烷,具有同分异构体,故C错误;
D、能使溴水或酸性KMnO4溶液褪色的C4H8的物质为丁烯,有三种同分异构体:CH3CH2CH=CH2,CH3CH=CHCH3,CH2=CH(CH3)2,故D正确;
故选D.
点评 本题考查有机物的性质与同分异构体,题目难度不大,注意同分异构体的书写方法,难度不大.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题

| A. | 虚线右上方的元素为均为金属元素 | |
| B. | 紧靠虚线两侧的元素都是两性金属元素 | |
| C. | 可在虚线附近寻找半导体材料(如Ge、Si等) | |
| D. | 可在虚线的右上方,可寻找耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | NH4+、K+、Al3+、Mg2+ |
| 阴离子 | HCO3-、Cl-、MnO4-、SO42- |
| A. | 肯定没有Mg2+、HCO3-、Cl-、MnO4- | |
| B. | 一定含有K+,且c(K+)=2mol/L | |
| C. | 该溶液可能是KAl(SO4)2和NH4Al(SO4)2的混合溶液 | |
| D. | 若仅根据实验③,将该溶液蒸干、灼烧,有可能得到仅含有氧化铝固体物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加体系的压强 | B. | 减少C的物质的量浓度 | ||
| C. | 增加A的物质的量 | D. | 升高体系的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.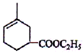 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在自然界中以化合态的形式存在 | B. | 单质常用作半导体材料和光导纤维 | ||
| C. | 最高价氧化物不与任何酸反应 | D. | 气态氢化物比甲烷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
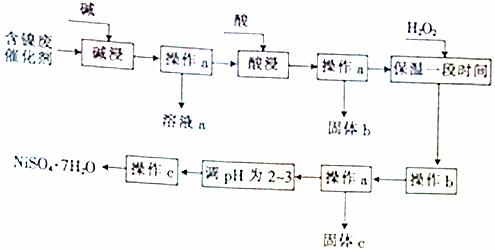
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com