
·ÖĪö £Ø1£©øł¾Ż»ÆŗĻ¼ŪÉż½µŹŲŗćČ·¶ØA”¢BµÄ»ÆŗĻ¼Ū£»
£Ø2£©Ķعż·½³ĢŹ½A+2HCl=ACl2+H2”ü£¬B+2HCl=BCl2+H2”ü£¬ÉčÉčA”¢BµÄĻą¶ŌŌ×ÓÖŹĮæ·Ö±šĪŖx£¬y£¬²¢øł¾ŻĢāøɽØĮ¢ĘšµČŹ½¹ŲĻµ£¬Ēóx£¬y¼“æÉ£»
£Ø3£©¾ŻĻą¶ŌŌ×ÓÖŹĮæČ·¶ØŌŖĖŲ£»
£Ø4£©øł¾ŻČŪµć£¬»ņÕß»īĘĆŠŌÅŠ¶Ļ£®
½ā“š ½ā£ŗ£Ø1£©n£ØH2£©=$\frac{2ag}{2g/mol}$=amol£¬“ÓH+”śH2»ÆŗĻ¼Ū½µµĶ2£¬¹ŹamolH2½µµĶ2amol£¬“ÓA”śAn+£¬»ÆŗĻ½«Éżøßn£¬¹ŹamolA£¬»ÆŗĻ½«Éżøßanmol£¬øł¾Ż»ÆŗĻ¼ŪÉż½µŹŲŗćµĆ£¬2a=an£¬½āµĆn=2£¬ŌŖĖŲBŅ²Ķ¬ŃłČē“Ė£®
“š£ŗŌŖĖŲAŗĶBµÄ»ÆŗĻ¼Ū¶¼ĪŖ+2¼Ū£»
£Ø2£©£©n£ØH2£©=$\frac{8.96}{22.4}$=0.4mol
ÉčA”¢BµÄĻą¶ŌŌ×ÓÖŹĮæ·Ö±šĪŖx£¬y£¬²¢Éč²Ī¼Ó·“Ó¦µÄAŗĶB¶¼ĪŖamol£®
A+2HCl=ACl2+H2ӟ
1 1
a a
B+2HCl=BCl2+H2ӟ
1 1
a a
$\left\{\begin{array}{l}{ax+ay=19.2}\\{a+a=0.4}\end{array}\right.$£¬µĆa=0.2mol£¬¹Ź0.2x+0.2y=19.2¢Ł£¬ÓÖŅņĪŖµČÖŹĮæµÄBŗĶAµÄŌ×ÓøöŹż±ČĪŖ1£ŗ1.4£¬¼“$\frac{\frac{m}{x}}{\frac{m}{y}}=\frac{1}{1.4}$£¬¼“$\frac{y}{x}=\frac{5}{7}$¢Ś£¬½«¢Ś“śČė¢ŁµĆ£¬x=40£¬y=56£¬¹ŹAµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ40£¬BµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ56£®
“š£ŗAµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ40£¬BµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ56£»
£Ø3£©AµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ40£¬¹ŹĪŖCa£¬BµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ56£¬¹ŹĪŖFe£®
“š£ŗŌŖĖŲAĪŖCa£¬ŌŖĖŲBĪŖFe£»
£Ø4£©ĢśµÄČŪµć±ČøĘøߣ¬¶ųĒŅĢśµÄ½šŹōŠŌƻӊøĘ»īĘĆ£¬¹Ź½šŹō¼üĒ棬¹Ź“š°øĪŖ£ŗFe£»ĢśµÄČŪµć±ČøĘøߣ¬¶ųĒŅĢśµÄ½šŹōŠŌƻӊøĘ»īĘĆ£¬¹Ź½šŹō¼üĒ森
µćĘĄ ±¾ĢāÄŃ¶Č½Ļ“ó£¬Ö÷ŅŖŹĒ»įŌĖÓĆ»ÆŗĻ¼ŪÉż½µŹŲŗć£¬Č„·ÖĪöŌŖĖŲµÄ»ÆŗĻ¼Ū£¬ŅŌ¼°ČŪ·Šµć£¬½šŹō»īĘĆŠŌ¶Ō½šŹō¼üµÄÓ°Ļģ£®


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĆܱÕČŻĘ÷ÖŠ9.6æĖĮņ·ŪÓė11.2æĖĢś·Ū»ģŗĻ¼ÓČČÉś³ÉĮņ»ÆŃĒĢś17.6æĖŹ±·Å³ö19.12 kJČČĮ棬ŌņFe£ØS£©+S£ØS£©=FeS£ØS£©”÷H=-95.6 kJ•mol-1 | |
| B£® | Ļ”“×ĖįŗĶ0.1mol/LµÄĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦£¬H+£Øaq£©+OH-£Øaq£©=H2O£Øl£©”÷H=-57.3kJ/mol | |
| C£® | ŅŃÖŖ1 molĒāĘųĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®Ėł·Å³öµÄČČĮæĪŖ285.5 kJ£¬ŌņĖ®·Ö½āµÄČČ»Æѧ·½³ĢŹ½£ŗ2H2O£Øl£©=2H2£Øg£©+O2£Øg£©”÷H=+285.5kJ/mol | |
| D£® | ŅŃÖŖ2C£Øs£©+O2£Øg£©=2CO£Øg£©”÷H=-221 kJ/mol£¬ŌņæÉÖŖCµÄČ¼ÉÕČČ”÷H=-110.5 kJ/mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
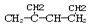 Ćū³ĘŹĒ1£¬3-¶ž¼×»ł-2-¶”Ļ©
Ćū³ĘŹĒ1£¬3-¶ž¼×»ł-2-¶”Ļ©| A£® | ¶¼²»ÕżČ· | B£® | ¢Ū¢Ż¢ŽÕżČ· | C£® | ¢Ś¢Ü¢ŽÕżČ· | D£® | ¢Ł¢Ū¢ŽÕżČ· |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | SO2+Br2+H2OØTH2SO4+2HBr | B£® | SO2+H2OØTH2SO3 | ||
| C£® | SO2+2NaOHØTNa2SO3+H2O | D£® | SO2+CaO$\frac{\underline{\;øßĪĀ\;}}{\;}$CaSO3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
| ĮņĖįČÜŅŗ/mL | 20.0 | 40.0 | 60.0 | 80.0 |
| Ź£Óą¹ĢĢå/g | 9.36 | 7.12 | 4.88 | 3.20 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
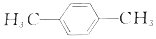 £©Óė¶Ō±½¶ž¼×Č©£Ø
£©Óė¶Ō±½¶ž¼×Č©£Ø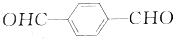 £©¾łæɱ»ŃõĘųÖ±½ÓŃõ»ÆĪŖ¶Ō±½¶ž¼×Ėį£¬Ē°ŗóĮ½ÖÖ·½°øÖŠ£¬ÖʱøµČĮæµÄ¶Ō±½¶ž¼×ĖįŹ±£®ĄķĀŪÉĻĻūŗĵÄŃõĘųĪļÖŹµÄĮæÖ®±ČĪŖ£Ø””””£©
£©¾łæɱ»ŃõĘųÖ±½ÓŃõ»ÆĪŖ¶Ō±½¶ž¼×Ėį£¬Ē°ŗóĮ½ÖÖ·½°øÖŠ£¬ÖʱøµČĮæµÄ¶Ō±½¶ž¼×ĖįŹ±£®ĄķĀŪÉĻĻūŗĵÄŃõĘųĪļÖŹµÄĮæÖ®±ČĪŖ£Ø””””£©| A£® | 3£ŗ1 | B£® | 2£ŗ1 | C£® | 1£ŗ1 | D£® | 4£ŗ1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŠæĪŖÕż¼« | B£® | µē×ӓӊ漫Į÷³ö | ||
| C£® | Šæ¼«·¢ÉśŃõ»Æ·“Ó¦ | D£® | µē½āŅŗæĻ¶Ø²»ŹĒĒæĖį |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.1 mol/L µÄĮņĖįļ§ČÜŅŗÖŠ£ŗc£ØNH4+£©£¾c£ØSO42?£©£¾c£ØH+£©£¾c£ØOH?£© | |
| B£® | 0.2mol/LNaHCO3ČÜŅŗÓė0.1mol/LNaOHČÜŅŗµČĢå»ż»ģŗĻ£ŗc£ØH+£©ØTc£ØOH?£©+c£ØHCO3?£©+2c£ØH2CO3£© | |
| C£® | pHÖ®ŗĶĪŖ14µÄH2C2O4ÓėKOH ČÜŅŗ»ģŗĻ£ŗc£ØK+£©£¾c£ØH+£©£¾c£ØOH?£©£¾c£ØHC2O4?£© | |
| D£® | pH=5 µÄH2SČÜŅŗÖŠ£¬c£ØH+£©£¾c£ØHS?£©=1”Į10-5mol/L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com