
| Y | Z | ||
| X | W |
| A. | 原子半径:X<Y<Z | |
| B. | 最高价氧化物的水化物的酸性:Y<W | |
| C. | 原子序数:X>W>Z>Y | |
| D. | Z、Y的单质均可与H2反应,且反应的剧烈程度:Y>Z |
分析 Y、W的原子序数之和是Z的3倍,设Y的原子序数为x,则Z的原子序数为x+1,W的原子序数为x+10,则x+x+10=3×(x+1),解得x=7,即Y为N,结合位置关系可知,Z为O,X为Si,W为Cl,然后结合元素化合物知识来解答.
解答 解:Y、W的原子序数之和是Z的3倍,设Y的原子序数为x,则Z的原子序数为x+1,W的原子序数为x+10,则x+x+10=3×(x+1),解得x=7,即Y为N,结合位置关系可知,Z为O,X为Si,W为Cl.
A.同周期自左而右原子半径减小,电子层越多原子半径越大,则原子半径为X>Y>Z,故A错误;
B.非金属性越强,最高价氧化物的水化物的酸性越强,非金属性:N<Cl,则最高价氧化物的水化物的酸性:Y<W,故B正确;
C.由元素在周期表中的位置可知,原子序数:W>X>Z>Y,故C错误;
D.元素非金属性越强,单质与氢气反应越剧烈,则O、N的单质均可与H2反应,且反应的剧烈程度:Z>Y,故D错误,
故选B.
点评 本题可知位置、结构与性质关系,熟练掌握周期表的计算,根据原子序数的关系推断元素为解答的关键,注意对元素周期律的理解应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
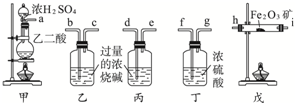
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨工业对工、农业生产和国防都有重要意义.
合成氨工业对工、农业生产和国防都有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
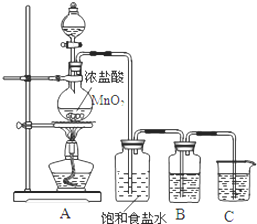 为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3是碱 | B. | NaHCO3是正盐 | C. | NaHCO3是强酸盐 | D. | NaHCO3是酸式盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
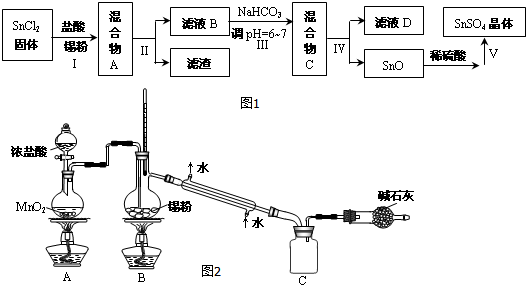
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
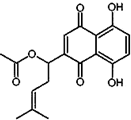 乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法错误的是( )
乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法错误的是( )| A. | 该分子中含有1个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1mol 乙酰紫草素最多可与2molBr2反应 | |
| D. | 1mol乙酰紫草素最多可与2molNaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com