
| A、a/576V mol?L-1 |
| B、a/125 mol?L-1 |
| C、250a/36V mol?L-1 |
| D、250a/48V mol?L-1 |
| m |
| M |
| n |
| V |
| ag |
| 96g/mol |
| a |
| 96 |
| a |
| 96 |
| 1 |
| 2 |
| 2 |
| 3 |
| a |
| 96 |
| 1 |
| 2 |
| a |
| 3×96 |
| ||
| 2VL |
| a |
| 576 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
A、常温下,将pH=11的氨水和pH=3的盐酸,等体积混合后,所得溶液中各离子浓度的关系是c(Cl-)>c(NH
| ||
| B、某二元酸在水中的电离方程式为:H2B═H++HB-,HB-?H++B2-,所以NaHB溶液呈酸性 | ||
| C、在BaSO4饱和溶液中加入少量的BaCl2溶液产生沉淀,平衡后的溶液中:C(Ba2+)?C(SO42-)>Ksp;c(Ba2+)>C(SO42-) | ||
| D、等浓度的NH3?H2O、NH4HSO4,NH4Cl溶液中c(NH4+)在逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大于40% | B、等于40% |
| C、小于40% | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁跟盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、碳酸氢钙溶液跟过量氢氧化钠溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| C、次氯酸钙溶液中通入过量的CO2:ClO-+H2O+CO2=HCO3-+HClO |
| D、氯化铝溶液与过量的氨水反应:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、电子式 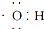 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
B、比例模型  可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 |
C、结构示意图为 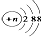 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
D、原子结构示意图 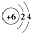 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤⑥⑦ | B、①④⑥⑦ |
| C、① | D、①④⑤⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com