
已知乙烯能发生以下转化:
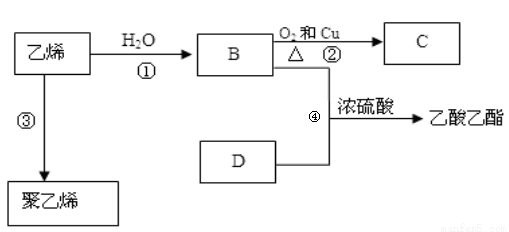
(1)乙烯的结构式为: 。
(2)B中官能团的电子式: ;D中官能团的名称: 。
(3)写出反应的化学方程式及反应类型:
② ;反应类型: ;
③ ;反应类型: ;
④ ;反应类型: 。
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源:2015-2016学年江苏省宿迁市高二下学期期末化学试卷(解析版) 题型:填空题
综合利用CO2、CO对构建低碳社会有重要意义。
(1)利用H2 和CO在一定条件下发生如下反应:CO(g)+2H2(g) CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
①10min后达到平衡时CO的浓度为 ;
②10min内用H2表示的平均反应速率为 ;
③若要加快CH3OH的生成速率,可采取的措施有 (填一种合理的措施)
(2)利用H2 和CO2在一定条件下可以合成乙烯:6H2+2CO2 CH2=CH2+4H2O
CH2=CH2+4H2O
①已知:4.4gCO2与H2完全转化为CH2=CH2和水(气态)共放出6.39kJ的热量,
写出该反应的热化学方程式 。
②不同温度对CO2的转化率及催化剂的催化效率的影响如图甲所示。

下列有关说法不正确的是 (填序号)。
A.不同条件下反应,N点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,乙烯的产量M点比N高
③若在密闭容器中充入体积比为 3∶1的 H2和CO2,则图甲中M点时,产物CH2=CH2的体积分数为 。(保留两位有效数字)
(3)利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图乙所示。在阴极上产生乙烯的电极反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省邯郸市高二下学期期末化学试卷(解析版) 题型:选择题
2015年,中国科学家屠呦呦获得了诺贝尔医学奖,因为发现青蒿素,一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”。如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
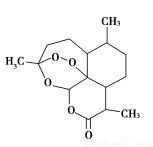
A.青蒿素分子式为C15H22O5
B.青蒿素易溶于乙醇、苯
C.青蒿素因含有—O—(醚键)而具有较强的氧化性
D.青蒿素在碱性条件下易发生水解反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:选择题
“绿色化学”对化学反应提出了“原子经济性”(原子节约)的新概念及要求,理想原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放。下列反应类型一定符合这一要求的是
①取代反应;②加成反应;③消去反应;④水解反应;⑤加聚反应;⑥缩聚反应;⑦酯化反应
A.①④ B.②③ C.⑤⑥ D.②⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:选择题
化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质 | 实际应用 | |
A | 乙酸具有酸性 | 常用于除水垢 |
B | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
C | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
D | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德一中高一下期末化学试卷(解析版) 题型:选择题
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是

A.反应的化学方程式为:2M N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德一中高一下期末化学试卷(解析版) 题型:选择题
0.1mol下列醇,与足量Na反应,在标准状况下可产生3.36L氢气的是
A.C2H5OH B.CH3OH C. D.
D.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西藏民族学院附中高二下期末化学卷(解析版) 题型:实验题
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.某同学查阅资料后设计生产NaClO2的主要流程如下。
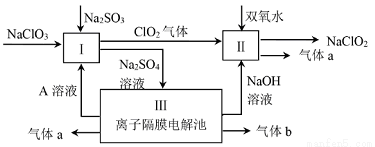
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是_________、_________(填化学式).
(2)Ⅱ中反应的离子方程式是_________;
(3)装置Ⅲ中A在_________极区产生.
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O.
①该反应中氧化剂和还原剂的物质的量之比是_________;
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是_________;
(5)NaClO2变质可分解为NaClO3和NaCl.取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省娄底市高一下学期期末化学试卷(解析版) 题型:选择题
下列物质中不属于离子化合物的是
A.NaOH B.HCl C.Na2O2 D.NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com