
| A、乙烯的最简式C2H4 |
| B、乙醇的结构简式C2H6O |
C、四氯化碳的电子式  |
| D、乙酸的分子式C2H4O2 |
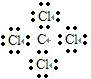 ,故C错误;
,故C错误;

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
| ||
| A、干电池是一种将化学能转变为电能的装置 |
| B、用普通干电池作电源,惰性材料做电极电解足量硫酸铜溶液时,当溶液中有0.8mol硫酸生成时,阴极析出标准状况下的气体体积为8.96L |
| C、步骤③:电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+ |
| D、步骤①:每析出12.8g S沉淀,共转移0.8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子键被破坏的变化一定是化学变化 |
| B、含有金属阳离子的晶体中一定有阴离子 |
| C、分子晶体中分子间作用力越大,分子越稳定 |
| D、NaCl熔化时离子键被破坏,冰熔化时分子中共价键没有断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2 L SO3所含的分子数为0.5 NA |
| B、1molCl2参加氧化还原反应,转移的电子数目一定是2 NA |
| C、在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2 NA |
| D、46 g二氧化氮和四氧化二氮混合气体中含有的原子数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO4溶液中加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3↑+H2O |
| C、高锰酸钾与乙醇制备Mn3O4纳米粉体,同时生成乙醛:6MnO4-+13CH3CH2OH→2Mn3O4+13CH3CHO+6OH-+10H2O |
| D、AlCl3溶液中滴加浓氨水至过量:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

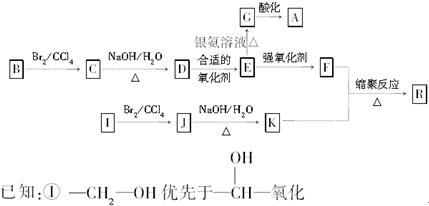
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com