
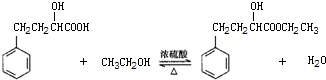
| 相对分子量 | 密度(g/cm3) | 沸点(℃) | 水溶性 | |
| 2-羟基-4-苯基丁酸 | 180 | 1.219 | 357 | 微溶 |
| 乙 醇 | 46 | 0.789 | 78.4 | 易溶 |
| 2-羟基-4-苯基丁酸乙酯 | 208 | 1.075 | 212 | 难溶 |
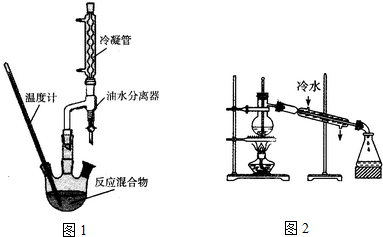
分析 (1)2-羟基-4-苯基丁酸于三颈瓶中,加入适量浓硫酸和20mL无水乙醇发生的是酯化反应,存在化学平衡,油水分离器的作用及时分离生成的水,促进平衡正向进行分析;
(2)温度过高,乙醇易挥发,会导致产率下降;
(3)取三颈烧瓶中的混合物分别用水、饱和碳酸氢钠溶液洗涤后,混合物中有少量的碳酸氢钠溶液要除去;
(4)在精制产品时,加入无水MgSO4,硫酸镁能吸水,在蒸馏装置中温度计的水银球的位置应与蒸馏烧瓶的支管口处相平齐,为有较好的冷却效果,冷凝水应采用逆流的方法;
(5)20mL 2-羟基-4-苯基丁酸的物质的量为$\frac{20×1.219}{180}$mol=0.135mol,20mL无水乙醇的物质的量为$\frac{20×0.789}{46}$mol=0.343mol,根据方程式 可知,乙醇过量,所以理论上产生2-羟基-4-苯基丁酸乙酯的质量为0.135mol×208g/mol=28.08g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
可知,乙醇过量,所以理论上产生2-羟基-4-苯基丁酸乙酯的质量为0.135mol×208g/mol=28.08g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)原料加入依据先加入密度小的再加入密度大的液体,所以浓硫酸应最后加入,防止浓硫酸使有机物脱水,被氧化等副反应发生,防止乙醇和酸在浓硫酸溶解过程中放热而挥发;2-羟基-4-苯基丁酸于三颈瓶中,加入适量浓硫酸和20mL无水乙醇发生的是酯化反应,存在化学平衡,油水分离器的作用及时分离生成的水,促进平衡正向进行分析,
故答案为:及时分离产物水,促进平衡向生成酯的反应方向移动;
(2)如果温度过高,乙醇易挥发,制备产率会减小,
故答案为:减小;
(3)取三颈烧瓶中的混合物分别用水、饱和碳酸氢钠溶液洗涤后,混合物中有少量的碳酸氢钠溶液要除去,所以要用水洗,
故答案为:洗掉碳酸氢钠;
(4)在精制产品时,加入无水MgSO4,硫酸镁能吸水,在蒸馏装置中温度计的水银球的位置应与蒸馏烧瓶的支管口处相平齐,为有较好的冷却效果,冷凝水应采用逆流的方法,所以装置中两处错误为温度计水银球的位置,冷凝水的方向,
故答案为:干燥;温度计水银球的位置,冷凝水的方向;
(5)20mL 2-羟基-4-苯基丁酸的物质的量为$\frac{20×1.219}{180}$mol=0.135mol,20mL无水乙醇的物质的量为$\frac{20×0.789}{46}$mol=0.343mol,根据方程式 可知,乙醇过量,所以理论上产生2-羟基-4-苯基丁酸乙酯的质量为0.135mol×208g/mol=28.08g,所以产率=$\frac{实际产量}{理论产量}$×100%=$\frac{9.0}{28.08}$×100%=32%,
可知,乙醇过量,所以理论上产生2-羟基-4-苯基丁酸乙酯的质量为0.135mol×208g/mol=28.08g,所以产率=$\frac{实际产量}{理论产量}$×100%=$\frac{9.0}{28.08}$×100%=32%,
故答案为:32%.
点评 本题考查了有机物的实验制备装置分析及原理应用,主要是酯化反应原理和实验过程的分析判断,掌握原理和基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溶液出现蓝色且30s内不褪色
溶液出现蓝色且30s内不褪色
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧空洞、温室效应、光化学烟雾、硝酸型酸雨的形成都与氮氧化合物有关 | |
| B. | 研制出性能优良的催化剂可使反应的温度降低,提高反应速率,从而起到很好的节能效果 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下△H 不同 | |
| D. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com