
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr2+ | 4.5 | 5.6 |
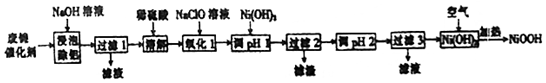
分析 由流程可知,废镍催化剂(主要含Ni、Al,少量Cr、FeS等)加氢氧化钠碱浸,Al溶解:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,过滤得到固体含有Ni、Cr、FeS,加入稀硫酸酸浸溶解,溶液含有Ni2+、Fe2+、Cr2+,加入NaClO氧化亚铁离子为铁离子,加入Ni(OH)2调节溶液PH使Fe3+和Cr2+全部沉淀,镍离子不沉淀,过滤后调节溶液PH得到Ni(OH)2沉淀,通过蒸发浓缩,冷却结晶,过滤洗涤得到NiSO4•7H2O晶体,在加热条件下与空气反应得到碱式氧化镍(NiOOH),据此分析解答.
解答 解:(1)“浸泡除铝”时,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(2)“溶解”时为Ni、Cr、FeS与稀硫酸反应,Ni+H2SO4═NiSO4+H2↑、Cr+H2SO4═CrSO4+H2↑、FeS+H2SO4═NiSO4+H2S↑;
故答案为:H2、H2S;
(3)“氧化1”时,酸性条件下,溶液中的Fe2+被NaClO氧化为Fe3+,其离子方程式为:ClO-+2Fe2++2H+=2Fe3++Cl-+2H2O;
故答案为:ClO-+2Fe2++2H+=2Fe3++Cl-+2H2O;
(4)加入Ni(OH)2调节溶液PH使Fe3+和Cr2+全部沉淀,镍离子不沉淀,故pH范围为5.6~6.2;
故答案为:5.6~6.2;Cr(OH)2和Fe(OH)3;
(5)在加热条件下Ni(OH)2与空气反应得到碱式氧化镍(NiOOH),化学方程式为:4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O;
故答案为:4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O;
(6)消耗KMnO4物质的量:0.01 mol•L-1×0.02L=2×10-4 mol,根据电子得失守恒可知Ni(OH)2的物质的量为1×10-3 mol,所以混合物中Ni(OH)2的物质的量为1×10-3mol×$\frac{200}{20}$=0.01mol,则Ni(OH)2的为:0/01mol×92.7g/mol=0.93g,
m(NiOOH)=8.29g-0.93g=7.36 g
n(NiOOH)=0.08mol
x:y=n(NiOOH):n[Ni(OH)2]=0.08 mol:0.01 mol=8:1,x=8,y=1;
故答案为:8;1.
点评 本题考查了物质分离方法和实验过程分析判断,侧重离子方程式的书写和氧化还原反应的计算应用,注意流程的理解,掌握实验基础和物质性质是关键,题目难度中等.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{Vd}{MN+2240}$ | B. | $\frac{1000Vd}{MN-2240}$ | C. | $\frac{1000VdM}{MN+2240}$ | D. | $\frac{MN}{22.4(V+0.1)d}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
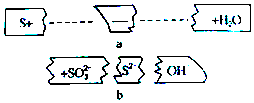
| A. | 氧化剂与还原剂的物质的量之比为2:1 | |
| B. | 该反应可能在酸性条件下进行 | |
| C. | 反应物微粒是S、SO32-、OH- | |
| D. | .2molS参加反应时,转移的电子数为$\frac{8}{3}$ NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 己烷有4种同分异构体,一定条件下能够发生取代反应 | |
| B. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| C. | 油脂皂化反应属于取代反应 | |
| D. | 聚合物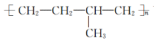 可由单体CH3CH═CH2和CH2═CH2加聚制得 可由单体CH3CH═CH2和CH2═CH2加聚制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素随着核电荷数的增大,单质的溶沸点升高 | |
| B. | 卤族元素随着核电荷数的增大,单质的氧化性增强 | |
| C. | HF、HCl、HBr、HI的稳定性依次逐渐减弱 | |
| D. | LiOH、NaOH、KOH的碱性依次逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
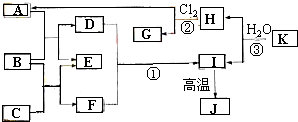 图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).
图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).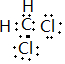 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com