
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 3 | ⑧ | ⑨ | ⑩ |
分析 由元素在周期表中位置,可知①为H、②为He、③为Li、④为C、⑤为N、⑥为O、⑦为F、⑧为Na、⑨为Mg、⑩为Si.
(1)能显+1价,还能显-1价的元素是氢、氯;
(2)稀有气体原子为稳定结构,最难形成离子;
(3)硅单质是良好的半导体材料;
(4)元素的气态氢化物既不和所有的酸作用,又不和所有的碱作用,为碳元素形成的氢化物;
(5)能跟氙、氪形成二元化合物的是氟元素;
(6)足球烯是碳元素的一种同素异形体;
(7)钠、氟气与冷水剧烈反应;
(8)a元素能以正化合价与b元素形成AB型化合物,该化合物常温下为固态且难溶于水,该化合物为MgO.
解答 解:由元素在周期表中位置,可知①为H、②为He、③为Li、④为C、⑤为N、⑥为O、⑦为F、⑧为Na、⑨为Mg、⑩为Si.
(1)能显+1价,还能显-1价的元素是氢、氯,故答案为:H、Cl;
(2)稀有气体He原子最外层为稳定结构,最难形成离子,故答案为:He;
(3)单质具有半导体性质的元素是Si,故答案为:Si;
(4)元素的气态氢化物既不和所有的酸作用,又不和所有的碱作用,为碳元素形成的氢化物,故答案为:C;
(5)F元素能跟氙、氪形成二元化合物,故答案为:F;
(6)足球烯是由碳元素组成的,故答案为:C;
(7)其单质能和冷水剧烈反应的元素是Na、F,故答案为:Na、F;
(8)a元素能以正化合价与b元素形成AB型化合物,该化合物常温下为固态且难溶于水,该化合物为MgO,则a为Mg、b为O元素,故答案为:Mg、O.
点评 本题考查元素周期表与元素周期律应用,熟练掌握元素周期表的结构,侧重考查学生对基础知识的掌握.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 选用480 mL 容量瓶 | |
| B. | 把烧碱固体放在纸上称量 | |
| C. | 把称好的固体放入容量瓶中稀释至刻度线 | |
| D. | 定容时俯视容量瓶的刻度线浓度偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3加热分解转化为Na2CO3 | |
| B. | 在水中的溶解度:Na2CO3比NaHCO3大 | |
| C. | 与同浓度的稀硫酸反应时,Na2CO3比NaHCO3剧烈 | |
| D. | NaHCO3能与NaOH反应,而Na2CO3不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
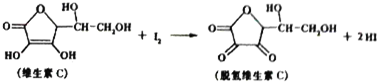
| A. | 脱氢维生素C的分子式为C6H7O6 | B. | 上述反应为氧化反应 | ||
| C. | 滴定时反应剧烈振荡锥形瓶 | D. | 滴定时不可以用淀粉溶液作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比丁烷更易液化 | B. | 是石油分馏的一种产品 | ||
| C. | 光照下能够发生取代反应 | D. | 分子中碳原子一定在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | A | B |
| 浓度/(mol•L-1) | 0.4 | 0.6 |
| A. | a=1.0 | |
| B. | 此时刻正反应速率小于逆反应速率 | |
| C. | 在相同条件下,若起始时加入2amolA,则达到平衡时A的转化率减小 | |
| D. | 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
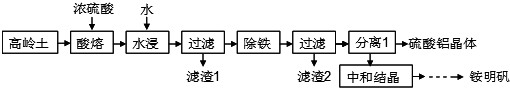
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com